Đề thi thử THPT Quốc gia môn Hóa học năm 2022 có đáp án (30 đề)
Đề thi thử THPT Quốc gia môn Hóa học năm 2022 có đáp án (Đề số 4)
-
14728 lượt thi
-
40 câu hỏi
-
60 phút
Danh sách câu hỏi
Câu 1:
Khi cho Fe tác dụng vừa đủ với dung dịch chứa H2SO4 loãng thu được sản phẩm gồm
 Xem đáp án
Xem đáp án
Đáp án B
Phản ứng xảy ra:
Fe + H2SO4 loãng FeSO4 + H2.
Câu 2:
Cho hỗn hợp Fe, Mg vào dung dịch AgNO3 và Cu(NO3)2 thì thu được dung dịch A và một kim loại. Kim loại thu được sau phản ứng là
 Xem đáp án
Xem đáp án
Đáp án B
Thứ tự cặp oxi hóa khử:
Ms2+/Mg ; Fe2+/Fe ; Cu2+/Cu ; Fe3+/Fe2+ ; Ag+/Ag => kim loại thu được chắc chắn phải có Ag.
Chú ý: Với các dạng này nên sắp xếp kim loại theo thứ tự mạnh yếu.
Câu 3:
Nhúng thanh Ni lần lượt vào các dung dịch: FeCl3, CuCl2, AgNO3, HCl và FeCl2. Số trường hợp xảy ra ăn mòn điện hóa là
 Xem đáp án
Xem đáp án
Đáp án C
Ăn mòn điện hóa học xảy ra khi thỏa mãn đủ 3 điều kiện sau:
- Các điện cực phải khác nhau về bản chất, thường là kim loại A-kim loại B, kim loại A-phi kim B (ví dụ: Fe-C).
- Các điện cực phải tiếp xúc trực tiếp hoặc gián tiếp với nhau qua dây dẫn.
- Các điện cực cùng tiếp xúc với dung dịch chất điện li (chú ý : không khí ẩm cũng coi là môi trường điện ly yếu)
- FeCl3: chỉ xảy ra ăn mòn hóa học: Ni + 2FeCl3 NiCl2 + 2FeCl2
- CuCl2: ban đầu Ni bị ăn mòn hóa học: Ni + CuCl2 NiCl2 + Cu
Cu sinh ra bám trực tiếp lên Ni xảy ra ăn mòn điện hóa đồng thời với ăn mòn hóa học.
- AgNO3: ban đầu Ni bị ăn mòn hóa học: Ni + 2AgNO3 Ni(NO3)2 + 2Ag
Ag sinh ra bám trực tiếp lên Ni xảy ra ăn mòn điện hóa đồng thời với ăn mòn hóa học.
- HC1 và FeCl2: chỉ xảy ra ăn mòn hóa học: Ni + 2HCl NiCl2 + H2, Ni không đẩy được Fe ra khỏi muối.
Có 2 trường hợp xảy ra ăn mòn điện hóa.
Câu 4:
Tiến hành điện phân dung dịch NaCl bằng điện cực trơ, thu được một khí X duy nhất. Điều khẳng định nào sau đây là đúng ?
 Xem đáp án
Xem đáp án
Đáp án C
Khi điện phân dung dịch NaCl bằng điện cực trơ: 2NaCl + 2H2O 2NaOH + H2 +Cl2
Nếu không có màng ngăn thì xảy ra thêm phản ứng: 2NaOH + Cl2 NaCl + NaClO + H2O
Để thu được khí X duy nhất thì không dùng màng ngăn xốp và khí duy nhất là H2.
Câu 5:
Khi cho Na dư vào 3 cốc đựng mỗi dung dịch: Fe2(SO4)3, FeCl2 và AlCl3 thì đều có hiện tượng xảy ra ở cả 3 cốc là
 Xem đáp án
Xem đáp án
Đáp án B
Hiện tượng đầu tiên xảy ra ở cả 3 cốc là sủi bọt khí không màu (H2) do phản ứng:
2Na + 2H2O 2NaOH + H2
Câu 6:
Ngâm một đinh sắt trong dung dịch HCl, phản ứng xảy ra chậm. Để phản ứng xảy ra nhanh hơn, người ta thêm tiếp vào dung dịch axit một vài giọt dung dịch nào sau đây?
 Xem đáp án
Xem đáp án
Đáp án D
Phản ứng xảy ra nhanh hơn khi xảy ra ăn mòn điện hóa => thêm dung dịch Cu(NO3)2
Câu 7:
Hãy cho biết dùng quỳ tím có thể phân biệt được dãy các dung dịch nào sau đây?
 Xem đáp án
Xem đáp án
Đáp án D
Amino axit có dạng: (H2N)x-R-(COOH)y xảy ra các trường hợp:
- x > y: dung dịch có pH > 7 và làm quỳ tím hóa xanh.
- x = y: dung dịch có pH = 7 và không làm đổi màu quỳ tím.
- x < y: dung dịch có pH < 7 và làm quỳ tím hóa đỏ.
Chỉ có D là quỳ tím đổi màu khác nhau nên nhận biết được
Câu 8:
Hoà tan hoàn toàn một lượng Ba vào dung dịch chứa a mol HCl thu được dung dịch X và a mol H2. Trong các chất sau: Na2SO4, Na2CO3, Al, Al2O3, AlCl3, Mg, NaOH và NaHCO3. Số chất tác dụng được với dung dịch X là
 Xem đáp án
Xem đáp án
Đáp án B
Do HCl hết, Ba tác dụng với H2O X chứa BaCl2 và Ba(OH)2.
Các chất tác dụng được với dung dịch X là Na2SO4, Na2CO3, Al, Al2O3, A1C13, NaHCO3
Câu 9:
Cho các polime sau: sợi bông (1), tơ tằm (2), sợi đay (3), tơ enang (4), tơ visco (5), tơ axetat (6), nilon-6,6 (7). Loại tơ có nguồn gốc xenlulozơ là?
 Xem đáp án
Xem đáp án
Đáp án D
Tơ có nguồn gốc từ xenlulozo là sợi bông, sợi đay, tơ visco, tơ axetat.
Câu 10:
Cho các chất: Ba; K2O; Ba(OH)2; NaHCO3; BaCO3; Ba(HCO3)2; BaCl2. Số chất tác dụng được với dung dịch NaHSO4 vừa tạo ra chất khí và chất kết tủa là
 Xem đáp án
Xem đáp án
Đáp án A
- Ba được vì:
Ba + 2H2O Ba(OH)2 + H2
Ba(OH)2 + 2NaHSO4 BaSO4 + Na2SO4 + 2H2O
- BaCO3 được vì:
BaCO3 + 2NaHSO4 BaSO4 + Na2SO4 + CO2 + H2O
- Ba(HCO3)2 được vì:
Ba(HCO3)2 + 2NaHSO4 BaSO4 + Na2SO4 + 2CO2 + 2H2O
Câu 11:
Cho lần lượt các chất sau: Fe dư, Fe3O4, Fe2O3, FeO, Fe(OH)2, Fe(OH)3, FeSO4, Fe2(SO4)3 tác dụng với dung dịch HNO3 đặc, nóng. Số chất tham gia phản ứng với HNO3 đặc, nóng tạo Fe3+ là
 Xem đáp án
Xem đáp án
Đáp án C
Các chất tác dụng với HNO3 đặc, nóng thu được Fe3+ là:
Fe3O4, Fe2O3, FeO, Fe(OH)2, Fe(OH)3, FeSO4.
Câu 12:
Cho 1,68 gam hỗn hợp A gồm Fe, Cu, Mg tác dụng hết với H2SO4 đặc, nóng. Sau phản ứng thấy tạo hỗn hợp muối B và khí SO2 có thể tích 1,008 lít (đktc). Tính khối lượng muối thu được
 Xem đáp án
Xem đáp án
Đáp án A
Dùng bán phản ứng:
mmuối = mKL + = 1,68 + 0,045. 96 = 6(g)
Câu 13:
Đốt môi sắt chứa kim loại M cháy ngoài không khí rồi đưa vào bình đựng khí CO2 (như hình vẽ). Thấy kim loại M tiếp tục cháy trong bình khí đựng CO2. Kim loại M là
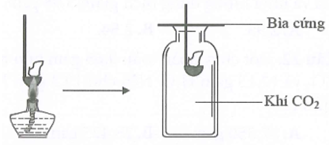
 Xem đáp án
Xem đáp án
Đáp án D
Câu 14:
Tổng hợp 120 kg poli (metyl metacrylat) từ axit cacboxylic và ancol thích hợp, hiệu suất của phản ứng este hóa là 30% và phản ứng trùng hợp là 80%. Khối lượng của axit tương ứng cần dùng là
 Xem đáp án
Xem đáp án
Đáp án B

Câu 15:
Xà phòng hóa chất béo X, thu được glixerol và hỗn hợp hai muối là natri oleat, natri panmitat có tỉ lệ mol 1:2. Hãy cho biết chất X có bao nhiêu công thức cấu tạo?
 Xem đáp án
Xem đáp án
Đáp án D

Câu 16:
Cho các chất sau: axetilen, metanal, axit fomic, metyl fomat, glixerol, saccarozơ, metyl acrylat, vinyl axetat, triolein, fructozơ, glucozơ. Số chất trong dãy làm mất màu dung dịch nước brom là
 Xem đáp án
Xem đáp án
Đáp án D

Câu 17:
Trong số các chất: phenylamoni clorua, natri phenolat, ancol etylic, phenyl benzoat, tơ nilon-6, ancol benzylic, alanin, Gly-Gly-Val, m-crezol, phenol, anilin, triolein, đivinyl oxalat. Số chất phản ứng được với dung dịch NaOH loãng, đun nóng là
 Xem đáp án
Xem đáp án
Đáp án D
Các chất phản ứng được với dung dịch NaOH loãng, nóng là: phenylamoni clorua, phenyl benzoat, tơ nilon-6, alanin, Gly-Gly-Val, m-crezol, phenol, triolein, đivinyl oxalat có 9 chất
Câu 18:
Hiđrocacbon mạch hở X (26 < Mx < 58). Trộn m gam X với 0,52 gam stiren thu được hỗn hợp Y. Đốt cháy hoàn toàn Y thu được 2,24 lít CO2 (đktc) và 0,9 gam H2O. Mặt khác, toàn bộ lượng Y trên làm mất màu tối đa a gam Br2 trong dung dịch. Giá trị của a là
 Xem đáp án
Xem đáp án
Đáp án D
Dễ thấy 0,1.12 + 0,05.2.1 = l,3 gam.
= 1,3 - 0,52 = 0,78 gam
C8H8 8CO2 + 4H2O
0,005 0,04 0,02 mol
Đốt 0,78 gam X được 0,06 mol CO2 và 0,03 mol H2O
Công thức đơn giản nhất của X là (CH)n, n là số chẵn, 26 < Mx < 58 X là C4H4 0,015 mol
C6H5-CH=CH2 + Br2 C6H5-CHBr-CH2Br
C4H4 + 3Br2 C4H4Br6
Vậy a = (0,005+0,015.3). 160 = 8 gam
Câu 19:
Amino axit X có công thức H2N-R(COOH)2. Cho 0,1 mol X vào V lít dung dịch H2SO4 0,5M, thu được dung dịch Y. Cho Y phản ứng vừa đủ với 100 ml dung dịch gồm: NaOH 1M và KOH 3M, thu được dung dịch chứa 36,7 gam muối. Phần trăm khối lượng của nitơ trong X là
 Xem đáp án
Xem đáp án
Đáp án A
Coi như X chưa tham gia phản ứng với H2SO4 Y là hỗn hợp gồm X và H2S04
Ta có 0,1 + 0,3 =
Mà =0,1 mol =0,1 (mol)
Bảo toàn khối lượng mx = 36,7 + 0,4. 18- 0,1. 98 - 0,3. 56- 0,1. 40 = 13,3 gam
MX = = 133 , X có 1 nguyên tử N %N= .100% = 10,526%.
Câu 20:
Cho 19,02 gam hỗn hợp Mg, Ca, MgO, CaO, MgCO3, CaCO3 tác dụng vừa đủ với m gam dung dịch HCl 10% thu được 4,704 lít hỗn hợp khí X (đktc). Biết khối lượng hỗn hợp khí X là 5,25 gam và dung dịch sau phản ứng chứa 19,98 gam CaCl2. Giá trị của m gần giá trị nào nhất sau đây?
 Xem đáp án
Xem đáp án
Đáp án A
X gồm H2 và CO2. Đặt = xmol; = y mol
= x + y = 0,21mol; = 5,25g = 44x + 2y.
Giải hệ có: x = 0,115 mol; y = 0,095 mol.
Quy đổi hỗn hợp ban đầu về Mg, Ca, o và CO2
=0,18mol.
Đặt = x; = y 24x + 0,18.40 + 16y + 0,115 . 44 = 19,02g.
Bảo toàn electron: 2x + 0,18.2 = 0,095.2 + 2y.
Giải hệ có: x = 0,135 mol; y = 0,22 mol.
= 2.0,135 + 2.0,18 = 0,63mol = 229,95(g).
Câu 21:
Hỗn hợp X gồm metyl fomat, anđehit acrylic và metyl acrylat. Đốt cháy hoàn toàn m gam X rồi hấp thụ hết sản phẩm cháy vào dung dịch Ca(OH)2 dư, thu được 10 gam kết tủa và khối lượng dung dịch giảm 3,98 gam. Giá trị của m là
 Xem đáp án
Xem đáp án
Đáp án D
mdung dịch giảm =
X gồm C2H4O2, C3H4O, C4H6O2
Nhận xét quan trọng: = 0,09.2 - 0,1 = 0,08 mol.
= 0,1. 12 + 0,09 . 2 + 0,08 . 16 = 2,66 gam.
Câu 22:
Đốt cháy hoàn toàn 9,65 gam hỗn hợp X gồm các amin no, hở thu được 17,6 gam CO2 và 12,15 gam H2O. Nếu cho 19,3 gam X tác dụng với HCl dư được m gam muối. Xác định m?
 Xem đáp án
Xem đáp án
Đáp án A
Ta có
nN/hỗn hợp amin =
mmuối = 9,65 + 0,25.36,5 = 18,775 gam.
Với 19,3 gam X thì mmuối = 18,775.2 = 37,55 gam
Câu 23:
X là dung dịch HCl nồng độ x mol/l. Y là dung dịch gồm Na2CO3 nồng độ y mol/l và NaHCO3 nồng độ 2y mol/l. Nhỏ từ từ đến hết 100 ml X vào 100 ml Y, thu được V lít khí CO2 (đktc). Nhỏ từ từ đến hết 100 ml Y vào 100 ml X, thu được 2V lít khí CO2 (đktc). Tỉ lệ x : y bằng
 Xem đáp án
Xem đáp án
Đáp án A
Nhận xét: do ở 2 thí nghiệm khác nhau phản ứng hết ở thí nghiệm 1 (vì nếu HCl hết ở cả 2 thí nghiệm thì lượng CO2 sinh ra phải bằng nhau)
= 0,lx mol; = 0,ly mol; = 0,2y mol .
Bản chất phản ứng:
- Thí nghiệm 1: nhỏ từ từ dung dịch chứa H+ vào dung dịch chứa thì thứ tự phản ứng xảy ra theo thứ tự như sau:
Công thức tính nhanh: = 0, lx - 0, ly
- Thí nghiệm 2: nhỏ từ từ dung dịch chứa , vào dung dịch chứa H+ thì xảy ra 2 phản ứng đồng thời với tốc độ như sau (không có sự ưu tiên về thứ tự phản ứng)
Công thức tính toán cho dạng 2 phản ứng song song cùng xảy ra:
Do ban đầu
=2. phản ứng = 2.phản ứng
Ta có:
Câu 24:
Trong các thí nghiệm sau:
(1) Cho SiO2 tác dụng với axit HF.
(2) Cho khí SO2 tác dụng với khí H2
(3) Cho khí NH3 tác dụng với CuO đun nóng.
(4) Cho CaOCl2 tác dụng với dung dịch HCl đặc.
(5) Cho Si đơn chất tác dụng với dung dịch NaOH.
(6) Cho khí O3 tác dụng với Ag.
(7) Cho dung dịch NH4Cl tác dụng với dung dịch NaNO2 đun nóng
(8) Điện phân dung dịch Cu(NO3)2
(9) Cho Na vào dung dịch FeCl3
(10) Cho Mg vào lượng dư dung dịch Fe2(SO4)3.
Số thí nghiệm tạo ra đơn chất là
 Xem đáp án
Xem đáp án
Đáp án A
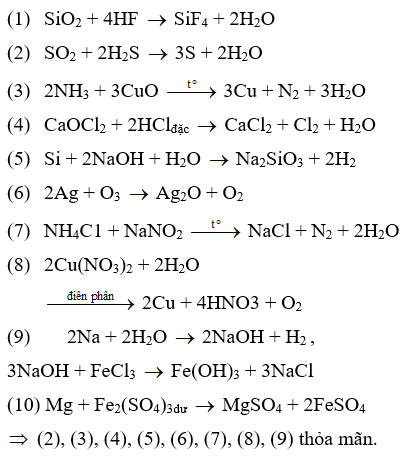
Câu 25:
Đốt cháy hoàn toàn m gam một triglixerit X cần vừa đủ x mol O2, sau phản ứng thu được CO2 và y mol H2O. Biết m = 78x - 103y. Nếu cho 0,15 mol X tác dụng với dung dịch nước Br2 dư thì lượng Br2 phản ứng tối đa là bao nhiêu mol?
 Xem đáp án
Xem đáp án
Đáp án A
Bảo toàn khối lượng:= m + 32x - 18y = 110x – 121y = 2,5x – 2,75y
Bảo toàn nguyên tố Oxi: = 0,5x - 0,75y
Ta có: (với k là độ bất bão hòa của HCHC).
Áp dụng: (2,5x – 2,75y) – y = (k – 1).(0,5x – 0,75y) k = 6
Mà
Câu 26:
Hỗn hợp E gồm chất X (C3H10N2O4) và chất Y (C3H12N2O3), biết X là hợp chất hữu cơ đa chức. Cho 3,86 gam E tác dụng với dung dịch NaOH dư, đun nóng, thu được 0,06 mol hai chất khí (có tỉ lệ mol 1 : 5, X và Y đều tạo khí làm xanh quỳ tím ẩm, 2 chất khí hơn kém nhau 1 nguyên tử cacbon) và dung dịch chứa m gam muối. Giá trị của m là
 Xem đáp án
Xem đáp án
Đáp án D
(k là độ bất bão hoà tính theo công thức phân tử, là số liên kết pi thực tế trong công thức cấu tạo , i là số liên kết ion trong công thức cấu tạo)
X có 4 nguyên tử O trong phân tử, nên X là muối của amoni của axit cacboxylic 2 chức nên = 2(có 2 liên kết trong 2 nhóm COO) i = - k = 2 (có 2 liên kết ion). Vậy X là muối amoni 2 chức của axit cacboxylic 2 chức.
Y có 3 nguyên tử O nên Y là muối amoni của 1 trong các gốc NH3 và CH3NH2 (đều có = 1)
i = - k = 2 (Y có 2 liên kết ion trong phân tử). Vậy Y là muối amoni 2 chức của axit cacbonic (gốc )
Do 2 khí thoát ra hơn kém nhau 1 nguyên tử C (NH3 và CH3NH2) và có tỉ lệ mol 1 : 5, nên ở đây chỉ cần xét 1 trường hợp thoả mãn được 2 điều kiện trên:
X : NH4OOC – COONH3CH3, Y: (CH3NH3)2CO3
NH4OOC-COONH3CH3 +2NaOH (COONa)2 +NH3 +CH3NH2 +2H2O
0,01 mol 0,01 mol
(CH3NH3)2CO3 + 2NaOH 2CH3NH2 + Na2CO3 + 2H2O
0,02 mol 0,02 mol
Ta có
Câu 27:
Để hòa tan hoàn toàn hỗn hợp X gồm 11,2 gam Fe và 11,6 gam Fe3O4 cần dùng tối thiểu V ml dung dịch HCl 2M, thu được dung dịch Y. Cho dung dịch AgNO3 vào dư vào Y thu được m gam kết tủa. Giá trị của V và m lần lượt là:
 Xem đáp án
Xem đáp án
Đáp án B

Câu 28:
Sục 13,44 lít CO2 (đktc) vào 200 ml dung dịch X gồm Ba(OH)2 1,5M và NaOH 1M. Sau phản ứng thu được dung dịch Y. Cho dung dịch Y tác dụng với 200 ml dung dịch hỗn hợp BaCl2 1M và NaOH 1,5M thu được m gam kết tủa. Giá trị của m là:
 Xem đáp án
Xem đáp án
Đáp án D
= 0,2 . (1,5.2 + 1) = 0,8 mol; = 0,6 mol.
sinh ra và
;
Câu 29:
Cho các nhận định sau:
(1) Ở điều kiện thường, trimetylamin là chất khí, tan tốt trong nước.
(2) Ở trạng thái tinh thể, các amino axit tồn tại dưới dạng ion lưỡng cực.
(3) Lực bazơ của các amin đều mạnh hơn amoniac.
(4) Oligopeptit gồm các peptit có từ 2 đến 10 gốc -amino axit và là cơ sở tạo nên
(5) Anilin để lâu ngày trong không khí có thể bị oxi hóa và chuyển sang màu nâu đen.
(6) Các amino axit có nhiệt độ nóng chảy cao, đồng thời bị phân hủy.
Số nhận định đúng là
 Xem đáp án
Xem đáp án
Đáp án B
(1) Đúng
(2) Đúng
(3) Sai, chẳng hạn anilin có tính bazơ yếu hơn NH3.
(4) Sai, polipeptit mới là cơ sở tạo nên
(5) Đúng
(6) Đúng
có 4 nhận định đúng.
Câu 30:
Hỗn hợp khí X có thể tích 4,48 lít (đo ở đktc) gồm H2 và vinylaxetilen có tỉ lệ mol tương ứng là 3:1. Cho hỗn hợp X qua xúc tác Ni nung nóng thu được hỗn hợp khí Y có tỉ khối so với H2 bằng 14,5. Cho toàn bộ hỗn hợp Y ở trên từ từ qua dung dịch nước brom dư (phản ứng hoàn toàn) thì khối lượng brom đã phản ứng là
 Xem đáp án
Xem đáp án
Đáp án C
Tính được
Khi nung nóng thì khối lượng hỗn hợp:
Từ tỉ khối hỗn hợp sau phản ứng với H2
Chú ý:
Thêm nữa, H2 phản ứng sẽ cộng vào nối đôi, làm mất 0,1 mol liên kết của hỗn hợp trước phản ứng.
Mà số mol lk trước phản ứng là: 0,05. 3 = 0,15 mol nên sau phản ứng chỉ còn 0,15 - 0,1 = 0,05 mol
Vậy khối lượng brom đã phản ứng sẽ là: 0,05. 160 = 8 gam.
Câu 31:
Cho các phát biểu sau
(a) Đun nóng dung dịch Ca(HCO3)2 có xuất hiện kết tủa.
(b) Tơ poliami kém bền trong dung dịch axit và dung dịch kiềm.
(c) Muối mononatri glutamat được ứng dụng làm mì chính (bột ngọt).
(d) Gly-Ala-Ala có phản ứng màu biure.
(e) Tính khử của Ag mạnh hơn tính khử của Cu.
(f) Nhiệt phân hoàn toàn Cu(NO3)2 tạo thành Cu.
(g) Trong công nghiệp dược phẩm, NaHCO3 được dùng để điều chế thuốc đau dạ dày.
Số phát biểu đúng là
 Xem đáp án
Xem đáp án
Đáp án C
Có 5 phát biểu đúng: (a), (b), (c), (d), (g).
Câu 32:
Cho các phát biểu sau
(a) Thủy phân hoàn toàn xenlulozơ hay tinh bột đều thu được glucozơ.
(b) Thủy phân hoàn toàn các triglixerit luôn thu được glixerol.
(c) Quặng boxit là nguyên liệu dùng để sản xuất nhôm.
(d) Trong công nghiệp, Al được sản xuất bằng phương pháp điện phân nóng chảy AlCl3.
(e) Hỗn hợp Na và Al2O3 (tỉ lệ mol 2:2 tương ứng) tan hết trong nước dư.
(f) Trong quá trình sản xuất etanol từ tinh bột, xảy ra phản ứng thủy phân và lên men rượu.
(g) Đun nóng dung dịch Ca(HCO3)2 có xuất hiện kết tủa.
Số phát biểu đúng là
 Xem đáp án
Xem đáp án
Đáp án C
Có 5 phát biểu đúng: (a), (b), (c), (f), (g).
Câu 33:
Cho các phát biểu sau
(a) Dầu dừa được dùng làm nguyên liệu để điều chế xà phòng.
(b) Nước ép quả nho chín có phản ứng tráng bạc.
(c) Hiđro hóa hoàn toàn chất béo lỏng thu được chất béo rắn.
(d) Đốt Fe trong khí clo dư thu được FeCl3.
(e) Hỗn hợp Cu, Zn, Fe tan hết trong dung dịch HCl dư.
(f) Hỗn hợp Na và Al(OH)3 (tỉ lệ mol 1: 2 tương ứng) tan hết trong nước dư.
(g) Đun nóng dung dịch Ba (HCO3)2 có xuất hiện kết tủa.
Số phát biểu đúng là
 Xem đáp án
Xem đáp án
Đáp án B
Có 5 phát biểu đúng: (a), (b), (c), (d), (g).
Câu 34:
Cho các phát biểu sau
(a) Nước quả chanh khử được mùi tanh của cá.
(b) Hỗn hợp Na2O và Al (tỉ lệ mol 1: 3) tan hết trong nước dư.
(c) Dung dịch axit glutamic không làm đổi màu quỳ tím.
(d) Metylamin là chất khí tan nhiều trong nước.
(e) Protein đơn giản chứa các gốc a-amino axit.
(f) Trong công nghiệp dược phẩm, NaHCO3 được dùng để điều chế thuốc đau dạ dày.
(g) Phân tử Gly-Ala-Val-Gly có 4 nguyên tử nitơ.
Số phát biểu đúng là
 Xem đáp án
Xem đáp án
Đáp án B
Có 5 phát biểu đúng: (a), (d), (e), (f), (g).
Câu 35:
X, Y, Z là 3 este đều đơn chức, mạch hở (trong đó Y và Z không no có một liên kết C=C và có tồn tại đồng phân hình học). Đốt cháy 21,62 gam hỗn hợp E chứa X, Y, Z với oxi vừa đủ, sản phẩm cháy dẫn qua dung dịch Ca(OH)2 dư thấy khối lượng dung dịch giảm 34,5 gam so với trước phản ứng. Mặt khác, đun nóng 21,62 gam E với 300 ml dung dịch NaOH 1M (vừa đủ), thu được hỗn hợp F chỉ chứa 2 muối và hỗn hợp gồm 2 ancol kế tiếp thuộc cùng dãy đồng đẳng. Khối lượng của muối có khối lượng phân tử lớn hơn trong hỗn hợp F là
 Xem đáp án
Xem đáp án
Đáp án D
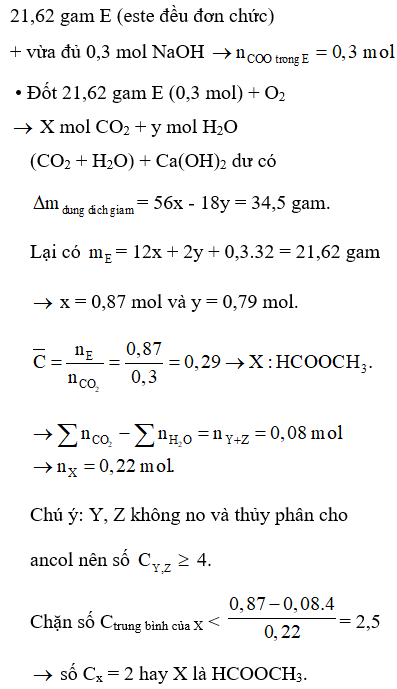

Câu 36:
Thủy phân m gam hỗn hợp X gồm 1 tetrapeptit A và 1 pentapeptit B (A và B đều hở chứa đồng thời Glyxin và Alanin trong phân tử) bằng 1 lượng dung dịch NaOH vừa đủ. Cô cạn dung dịch sản phẩm cho (m + 15,8) gam hỗn hợp muối. Đốt cháy toàn bộ lượng muối sinh ra bằng 1 lượng oxi vừa đủ, thu được Na2CO3 và hỗn hợp hơi Y gồm CO2, H2O và N2. Dẫn Y đi qua bình đựng dung dịch NaOH đặc dư, thấy khối lượng bình tăng thêm 56,04 gam so với ban đầu và có 4,928 lít khí duy nhất (đktc) thoát ra khỏi bình. Xem như N2 không bị nước hấp thụ, các phản ứng xảy ra hoàn toàn. Thành phần phần trăm khối lượng của B trong hỗn hợp X là
 Xem đáp án
Xem đáp án
Đáp án C
Quy X về , CH2, H2O = 2 = 2.0,22 = 0,44 mol.
Muối gồm 0,44 mol C2H4NO2Na và X mol CH2
đốt cho CO2: (0,66 + x) mol và H2O: (0,88 + x) mol
mbình tăng = = 56,04 x = 0,18 mol.
Bảo toàn khối lượng:
m + 0,44.40 = m + 15,8 + = 0,1 mol.
Đặt = a; = b nx = a + b = 0,1 mol; = 0,44 mol = 4a + 5b
Giải hệ có: a = 0,06 mol; b = 0,04 mol.
=0,18 mol; = 0,44 - 0,18 = 0,26 mol.
Gọi số gốc Ala trong A và B là m và n ( )
0,06m + 0,04n = 0,18. Giải phương trình nghiệm nguyên có: m = 1; n = 3.
B là
Câu 37:
Hỗn hợp E gồm este X đơn chức và axit cacboxylic Y hai chức (đều mạch hở, không no có một liên kết đôi C=C trong phân tử). Đốt cháy hoàn toàn một lượng E thu được 0,43 mol khí CO2 và 0,32 mol hơi nước. Mặt khác, thủy phân 46,6 gam E bằng 200 gam dung dịch NaOH 12% rồi cô cạn dung dịch thu được phần hơi Z có chứa chất hữu cơ T. Dẫn toàn bộ Z vào bình kín đựng Na, sau phân ứng khối lượng bình tăng 188,85 gam đồng thời sinh ra 6,16 lít khí H2 (đktc). Biết tỉ khối của T so với H2 là 16. Phần trăm khối lượng của Y trong hỗn hợp E có giá trị gần nhất với giá trị nào sau dây?
 Xem đáp án
Xem đáp án
Đáp án D
X và Y lần lượt có dạng và ().
Ta có: (với k là độ bất bão hòa của hợp chất hữu cơ).
Áp dụng: nx + 2nY = = 0,11 mol.
= 0,43.12 + 0,32.2 + 0,11. 2. 16 = 9,32(g).
Thí nghiệm 2 dùng gấp thí nghiệm 1 là = 5 lần.
= 0,11 . 5 = 0,55 mol < = 0,6 mol NaOH dư.
= 176(g). Đặt nx = x; = y x + 2y = 0,55 mol.
= 176 + 18 X 2y = (176 + 36y) (g); MT = 32 T là với số mol là x.
= 188,85(g) = 176 + 36y + 32x - 0,275.2
Giải hệ có: x = 0,25 mol; y = 0,15 mol.
Đặt số C của X và Y là a và b (a > 4; b > 4) 0,25a + 0,15b = 0,43. 5
Giải phương trình nghiệm nguyên có: a = 5; b = 6.
Y là C6H804 = 46,35%.
Câu 38:
Tiến hành điện phân dung dịch chứa NaCl 0,4M và Cu(NO3)2 0,5M bằng điện cực trơ, màng ngăn xốp với cường độ dòng điện không đổi I = 5 A trong thời gian 8492 giây thì dừng điện phân, ở anot thoát ra 3,36 lít khí (đktc). Cho m gam bột Fe vào dung dịch sau điện phân, kết thúc phản ứng, thấy khí NO thoát ra (sản phẩm khử duy nhất của N+5) và 0,8m gam rắn không tan. Giá trị của m là
 Xem đáp án
Xem đáp án
Đáp án B
Ta có ne trao đổi =
Giả sử tại anot chỉ có Cl2 vô lý.
Tại anot chỉ có khí Cl2 và khí O2.
Quá trình điện phân ở anot:
- Dung dịch sau điện phân chứa Na+ (0,16 mol), (0,4 mol) và H+
+ Xét dung dịch sau điện phân có:
- Cho m gam Fe tác dụng với dung dịch trên thì:
3Fe + 8H+ + 2 3Fe2+ + 2NO + 4H2O
0,24 0,4 0,09 mol
+ Theo đề ta có: mFe - mrắn không tan = mFe( bị hòa tan) m – 0,8m = 0,09.56 m=25,2 (g)
Câu 39:
Hòa tan hết 31,12 gam hỗn hợp X gồm Mg, Fe, Fe3O4, FeCO3 vào dung dịch hỗn hợp chứa H2SO4 và KNO3. Sau phản ứng thu được 4,48 lít hỗn hợp khí Y (đktc) gồm (CO2, NO, NO2, H2) có tỉ khối so với H2 là 14,6 và dd Z chỉ chứa các muối trung hòa (Z không chứa Fe3+) với tổng khối lượng là m gam. Cho BaCl2 dư vào Z thấy xuất hiện 140,965 gam kết tủa trắng. Mặt khác cho NaOH dư vào Z thì thấy có 1,085 mol NaOH phản ứng đồng thời xuất hiện 42,9 gam kết tủa và 0,56 lít khí (đktc) thoát ra. Biết các phản ứng xảy ra hoàn toàn. Cho các nhận định sau:
(a) Giá trị của m là 82,285 gam.
(b) Số mol của KNO3 trong dung dịch ban đầu là 0,225 mol
(c) Phần trăm khối lượng FeCO3 trong X là 18,638%.
(d) Số mol của Fe3O4 trong X là 0,05 mol.
(e) Số mol của Mg trong X là 0,15 mol.
Tổng số nhận định đúng là
 Xem đáp án
Xem đáp án
Đáp án A
Y chứa H2 z không chứa . Lập sơ đồ phản ứng:
Bảo toàn điện tích:
b sai
• Đặt = x mol; = y mol nNaOH = 2x + 2y + 0,025 = 1,085 mol;
mkết tủa = 58x + 90y = 42,9g.
Giải hệ có: x = 0,15 mol; y = 0,38 mol (e) đúng.
m = 0,15. 24 + 0,38. 56 + 0,125. 39 + 0,025. 18 + 0,605. 96 = 88,285(g) (a) sai.
Bảo toàn khối lượng: = 31,12 + 0,605. 98 + 0,125.101 - 88,285 - 0,2 .29,2 = 8,91(g)
= 0,495 mol.
Bảo toàn nguyên tô Hidro: = (0,605 .2 - 0,025. 4 - 0,495. 2)/2 = 0,06 mol.
Bảo toàn nguyên tố Nitơ: 0,125-0,025 = 0,l mol .
=0,2 - 0,1 - 0,06 = 0,04mol ( c) sai
= 31,12 - 0,15 . 24 - 0,38 . 56 - 0,04 . 60 = 3,84(g).
= 0,24 mol = 0,06 moL (d) sai chỉ có (e) đúng
Câu 40:
Tiến hành thí nghiệm với lòng trắng trứng
Bước 1: Cho vào ống nghiệm 2 – 3 ml dung dịch protein 10% (lòng trắng trứng 10%).
Bước 2: Đun nóng ống nghiệm trên ngọn lửa đèn cồng cho đến sôi trong khoảng 1 phút.
Nhận định nào sau đây là đúng?
 Xem đáp án
Xem đáp án
Đáp án A.
Hiện tượng quan sát được là lòng trắng trứng đục dần sau đó đông tụ lại thành từng mảng bám vào thành ống nghiệm do khi đun nóng xảy ra hiện tượng đông tụ protein.
