Đề thi thử THPT Quốc gia môn Hóa học năm 2022 có đáp án (30 đề)
Đề thi thử THPT Quốc gia môn Hóa học năm 2022 có đáp án (Đề số 18)
-
14716 lượt thi
-
40 câu hỏi
-
60 phút
Danh sách câu hỏi
Câu 1:
Để tạo độ xốp cho một số loại bánh, có thể dùng muối nào sau đây làm bột nở?
 Xem đáp án
Xem đáp án
Đáp án D
Để tạo độ xốp cho một số loại bánh, có thể dung muối NH4HCO3
Câu 2:
Etyl axetat có công thức cấu tạo thu gọn là
 Xem đáp án
Xem đáp án
Đáp án C
Etyl axetat có công thức cấu tạo thu gọn là CH3COOC2H5
Câu 3:
Polime được điều chế bằng phản ứng trùng ngưng là
 Xem đáp án
Xem đáp án
Đáp án B
Polime được điều chế bằng phản ứng trùng ngưng là nilon-6,6.
Phương trình phản ứng:
- Các polime còn lại đều được điều chế bằng phản ứng trùng hợp.
Câu 4:
Muốn bảo quản kim loại kiềm, người ta ngâm chúng trong
 Xem đáp án
Xem đáp án
Đáp án C
Muốn bảo quản kim loại kiềm, người ta ngâm kín chúng trong dầu hỏa vì Na không tác dụng với dầu hỏa, dầu hỏa ngăn không cho Na tiếp xúc với không khí (có lẫn O2, H2O, …).
Phương án A, B, D sai vì Na tác dụng với axit, nước nên không dùng để bảo quản.
Câu 6:
Chất nào sau đây thuộc loại monosaccarit?
 Xem đáp án
Xem đáp án
Đáp án B
- Glucozơ thuộc loại monosaccarit.
- Saccarozơ thuộc loại đisaccarit.
- Aminozơ và xenlulozơ thuộc loại polisaccarit.
Câu 7:
Kim loại có khả năng dẫn điện tốt nhất và kim loại có độ cứng lớn nhất lần lượt là:
 Xem đáp án
Xem đáp án
Đáp án D
Kim loại có khả năng dẫn điện tốt nhất và kim loại có độ cứng lớn nhất lần lượt là Ag và Cr.
Câu 8:
Hợp chất nào của canxi được dùng để đúc tượng, bó bột khi gãy xương?
 Xem đáp án
Xem đáp án
Đáp án A
Chất được dùng để đúc tượng, bó bột khi gãy xương là thạch cao nung (CaSO4, H2O).
Câu 9:
Hiệu ứng nhà kính là hiện tượng Trái đất đang ấm dần lên, do các bức xạ có bước sóng dài trong vùng hồng ngoại bị giữ lại, mà không bức xạ ra ngoài vũ trụ. Chất khí nào sau đây là nguyên nhân gây ra hiệu ứng nhà kính?
 Xem đáp án
Xem đáp án
Đáp án A
Khi gây ra hiệu ứng nhà kính là CO2.
Câu 10:
Khí nào sau đây gây ra hiện tượng mưa axit?
 Xem đáp án
Xem đáp án
Đáp án B
Khí gây ra hiện tượng mưa axit là SO2 vì tác dụng với H2O sinh ra axit H2SO3.
Câu 11:
Dung dịch chất nào sau đây có phản ứng màu biure?
 Xem đáp án
Xem đáp án
Đáp án C
Dung dịch anbumin có phản ứng màu biure vì có nhiều liên kết peptit.
Nhắc lại kiến thức: peptit có từ hai liên kết peptit trở lên có phản ứng màu biure, trong khi anbumin là polipeptit.
Câu 12:
Cho các chất sau: . Số chất điện li yếu là
 Xem đáp án
Xem đáp án
Đáp án D
Chất điện li yếu là H2O, HF, CH3COOH, H2S
Câu 14:
Kim loại không phản ứng với nước ở nhiệt độ thường là
 Xem đáp án
Xem đáp án
Đáp án A
Do Ag có tính khử yếu nên không tác dụng với H2O
Câu 15:
Hình vẽ mô tả thí nghiệm phân tích định tính cacbon và hidro:
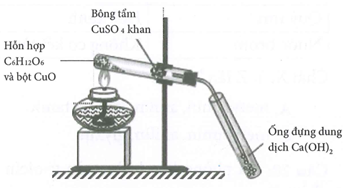
Cho các phát biểu về thí nghiệm trên:
(a) Vai trò của CuSO4 khan là để nhận biết nguyên tố oxi.
(b) Ống nghiệm đựng dung dịch Ca(OH)2 vẩn đục chứng tỏ có nguyên tố hidro.
(c) Lắp ống nghiệm chứa C6H12O6 và CuO chúc xuống để tránh hơi nước ngưng tụ chảy xuống có thể gây nứt ống nghiệm.
(d) Có thể thay glucozơ (C6H12O6) bằng saccarozơ.
(e) Khi tháo dụng cụ, nên tắt đèn cồn rồi để nguội mới tháo ống dẫn khí khỏi nước vôi trong.
(g) Nếu thay dung dịch Ca(OH)2 bằng dung dịch NaOH thì hiện tượng xảy ra tương tự.
Số phát biểu đúng là
 Xem đáp án
Xem đáp án
Đáp án B
(a) Sai, Vai trò của CuSO4 khan là để nhận biết nguyên tố hidro vì CuSO4 khan có màu trắng chuyển thành màu xanh khi gặp nước.
(b) Sai, Ống nghiệm đựng dung dịch Ca(OH)2 vẩn đục chứng tỏ có nguyên tố cacbon
(c) Đúng, Nếu lắp ống nghiệm chứa C6H12O6 và CuO hướng lên thì hơi nước ngưng tụ chảy xuống đáy ống nghiệm có thể gây nứt ống nghiệm.
(d) Đúng, Có thể thay glucozơ (C6H12O6) bằng saccarozơthì hiện tượng xảy ra tương tự.
(e) Đúng, Khi tháo dụng cụ, nên tắt đèn cồn rồi để nguội mới tháo ống dẫn khí khỏi nước vôi trong để tránh nước bị hút vào ống nghiệm do áp suất giảm.
(g) sai, Nếu thay dung dịch Ca(OH)2 bằng dung dịch NaOH thì có phản ứng nhưng không xuất hiện kết tủa.
Câu 16:
Tỉ lệ số người chết về bệnh phổi do hút thuốc lá (kể cả hút thụ động) cao gấp hàng chục lần số người không hút thuốc lá. Chất gây nghiện và gây ung thư có trong thuốc lá là
 Xem đáp án
Xem đáp án
Đáp án B
Chất gây nghiện và gây ung thư có trong thuốc lá là nicotin.
Câu 17:
Cho sơ đồ phản ứng:
Nhận xét nào về các chất X, Y và T trong sơ đồ trên là đúng?
 Xem đáp án
Xem đáp án
Đáp án D
- Phương trình phản ứng:
Câu 18:
Cho dung dịch chứa a mol NaHCO3 vào dung dịch chứa a mol NaHSO4 rồi đun nóng. Sau khi phản ứng xảy ra hoàn toàn, thu được dung dịch X và khí Y.
Phát biểu nào sau đây đúng?
 Xem đáp án
Xem đáp án
Đáp án C
Dung dịch X là Na2SO4 có môi trường trung tính nên không làm chuyển màu quỳ tím.
Câu 19:
Hiện tượng khi làm thí nghiệm với các chất X, Y, Z ở dạng dung dịch được ghi lại như sau:
| X | Y | Z | |
| Quỳ tím | Hóa xanh |
Không đổi màu |
Không đổi màu |
| Nước brom | Không có kết tủa |
Kết tủa trắng |
Không có kết tủa |
Chất X, Y, Z lần lượt là:
 Xem đáp án
Xem đáp án
Đáp án C
- Metyl amin làm quì tím hóa xanh.
- Anilin tác dụng với nước brom cho kết tủa màu trắng.
- Glyxin không làm đổi màu quỳ tím và không có kết tủa khi cho vào nước brom.
Câu 20:
Xà phòng hóa hoàn toàn triolein bằng dung dịch NaOH vừa đủ, thu được sản phẩm là
 Xem đáp án
Xem đáp án
Đáp án B
Câu 21:
Cho các phản ứng:
Dãy các chất và ion nào sau đây được xếp theo chiều giảm dần tính oxi hóa?
 Xem đáp án
Xem đáp án
Đáp án D
- Xét các phản ứng:
- Phản ứng oxi hóa khử xảy ra theo chiều tạo chất oxi hóa yếu hơn và chất khử yếu hơn
+ Phản ứng (1): Tính oxi hóa của
+ Phản ứng (2): Tính oxi hóa của
+ Phản ứng (3): Tính oxi hóa của
Vậy chiều giảm dần tsinh oxi hóa là .
Câu 22:
Cho 14 gam hỗn hợp X gồm phenol và etanol tác dụng với Na dư, thu được 2,24 lít khí H2 (đktc). Phần trăm khối lượng của phenol trong X là
 Xem đáp án
Xem đáp án
Đáp án A
Câu 23:
Trong phòng thí nghiệm, etyl axetat được điều chế theo các bước:
Bước 1: Cho 1 ml ancol etylic, 1 ml axit axetic nguyên chất và 1 giọt axit sunfuric đặc vào ống nghiệm.
Bước 2: Lắc đều, đồng thời đun cách thủy 5 – 6 phút trong nồi nước nóng 65 – 700C.
Bước 3: Làm lạnh rồi rót thêm vào ống nghiệm 2 ml dung dịch NaCl bão hòa.
Cho các phát biểu sau:
(a) Có thể thay dung dịch axit sunfuric đặc bằng dung dịch axit sunfuric loãng.
(b) Có thể tiến hành thí nghiệm bằng cách đun sôi hỗn hợp.
(c) Để kiểm soát nhiệt độ trong quá trình đun nóng có thể dùng nhiệt kế.
(d) Dung dịch NaCl bão hòa được thêm vào ống nghiệm để phản ứng đạt hiệu suất cao hơn.
(e) Có thể thay dung dịch NaCl bão hòa bằng dung dịch HCl bão hòa.
(g) Để hiệu suất phản ứng cao hơn nên dùng dung dịch axit axetic 15%.
Số phát biểu sai là
 Xem đáp án
Xem đáp án
Đáp án D
(a) Sai, Nếu dùng axit sunfuric loãng thì hiệu suất phản ứng rất thấp.
(b) Sai, Có thể đun trực tiếp ống nghiệm chứa hỗn hợp trên ngọn lửa đèn cồn nhưng không đun sôi để tránh hỗn hợp bay hơi.
(c) Đúng, Để tránh nhiệt độ quá cao thì dùng nhiệt kế để kiểm soát nhiệt độ trong quá trình đun nóng, tránh nhiệt độ cao làm bay hơi hết hỗn hợp.
(d) Sai, Dung dịch NaCl bão hòa được thêm vào ống nghiệm để este dễ tách ra khỏi dung dịch.
(e) Sai, Không thể thay dung dịch NaCl bão hòa bằng dung dịch HCl bão hòa.
(g) Sai, Dùng dung dịch axit axetic 15% (loãng) thì phản ứng hầu như không xảy ra.
Câu 24:
Cho dãy các chất: . Số chất trong dãy có tính lưỡng tính là
 Xem đáp án
Xem đáp án
Đáp án D
Chất có tính lưỡng tính là Al2O3, Al(OH)3
Câu 25:
Cho phát biểu sau:
(a) Glucozơ phản ứng với H2 (t0, Ni) cho sản phẩm là sobitol.
(b) Trong môi trường axit, glucozơ và fructozơ có thể chuyển hóa lẫn nhau.
(c) Có thể phân biệt glucozơ và fructozơ bằng phản ứng với dung dịch AgNO3 trong NH3.
(d) Trong dung dịch, glucozơ và fructozơ đều hòa tan Cu(OH)2 ở nhiệt độ thường.
(e) Fructozơ là hợp chất đa thức.
(g) Có thể điều chế ancol etylic từ glucozơ bằng phương pháp sinh hóa.
Số phát biểu đúng là
 Xem đáp án
Xem đáp án
Đáp án B
(b) Sai, Trong môi trường bazơ, glucozơ và fructozơ có thể chuyển hóa lẫn nhau.
(c) Sai, Có thể phân biệt glucozơ và fructozơ bằng phản ứng với dung dịch Br2.
(e) Sai, fructozơ là hợp chất hữu cơ tạp chức.
Câu 26:
Cho 27,4 gam kim loại Ba vào 120 gam dung dịch chứa 0,05 mol (NH4)2SO4 và 0,05 mol CuSO4 sau đó đun nóng để khí thoát ra hết. Sau khi kết thúc các phản ứng, thu được dung dịch X (coi như nước bay hơi không đáng kể). Nồng độ phần trăm của chất tan trong X là
 Xem đáp án
Xem đáp án
Đáp án A
Vì Trong X có chứa Ba(OH)2 dư (0,1 mol).
Kết quả thu được gồm Cu(OH)2 (0,05 mol); BaSO4 (0,1 mol) và khí NH3 thoát ra (0,1 mol)
=> mdd sau pư=
Câu 27:
Cho hỗn hợp X gồm 0,1 mol etilen, 0,1 mol metylaxetilen, 0,1 mol isopren và 0,7 mol H2 vào bình kín có xúc tác Ni nung nóng một thời gian, thu được hỗn hợp Y có tỉ khối hơi so với He là d. Mặt khác, toàn bộ Y tác dụng tối đa với 48,0 gam brom trong dung dịch. Giá trị của d là
 Xem đáp án
Xem đáp án
Đáp án B
Câu 28:
Cho hỗn hợp chứa a mol kim loại X và a mol kim loại Y vào nước dư, thu được dung dịch Z. Tiến hành các thí nghiệm sau:
Thí nghiệm 1: Cho dung dịch chứa 2a mol HCl vào dung dịch Z, thu được n1 mol kết tủa.
Thí nghiệm 2: Cho dung dịch chứa 1,5a mol H2SO4 vào dung dịch Z, thu được n2 mol kết tủa.
Thí nghiệm 3: Cho dung dịch chứa 0,5a mol HCl và a mol H2SO4 vào dung dịch Z, thu được n3 mol kết tủa. Biết các phản ứng xảy ra hoàn toàn và . Hai kim loại X và Y lần lượt là:
 Xem đáp án
Xem đáp án
Đáp án B
Theo phản ứng:
Thí nghiệm 1:
Thí nghiệm 2:
Thí nghiệm 3:
Cả 3 thí nghiệm đều có sự hòa tan kết tủa => số mol H+ càng lớn thì số mol kết tủa càng nhỏ
=> với thì chỉ có Na và Al thỏa mãn.
Câu 29:
Đốt cháy hoàn toàn m gam hỗn hợp X gồm xenlolozơ, glucozơ, saccarozơ bằng oxi dư, cho toàn bộ sản phẩm cháy vào bình đựng dung dịch Ca(OH)2 dư, thu được gam kết tủa và khối lượng bình tăng gam. Giá trị của m là
 Xem đáp án
Xem đáp án
Đáp án A
Ta có:
Câu 30:
Cho từ từ dung dịch HCl vào dung dịch X chứa a mol Ba(OH)2 và b mol Ba(AlO2)2. Đồ thị biểu diễn số mol Al(OH)3 theo số mol HCl như sau:
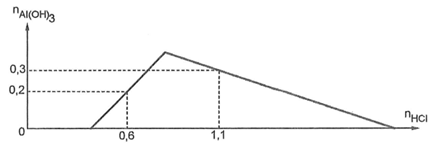
Cho toàn bộ X tác dụng với 820 ml dung dịch H2SO4 1M thì thu được bao nhiêu gam kết tủa?
 Xem đáp án
Xem đáp án
Đáp án C
Tại
Tại
Nếu cho vào dung dịch X thu được
Câu 31:
Hỗn hợp X gồm C2H5OH, C2H5COOH, CH3CHO trong đó C2H5OH chiếm 50% theo số mol. Đốt cháy m gam X, thu được 3,06 gam H2O và 3,136 lít CO2 (đktc). Mặt khác, 2m gam X tác dụng với dung dịch AgNO3 dư trong NH3 (đun nóng), thu được m gam Ag. Biết các phản ứng xảy ra hoàn toàn. Giá trị của m là
 Xem đáp án
Xem đáp án
Đáp án C
Trong 2m gam X có
Câu 32:
Hòa tan hết 0,3 mol hỗn hợp X gồm Ca và Ba trong dung dịch HCl dư, thu được dung dịch Y chứa m gam muối. Cho dung dịch Na2CO3 đến dư vào dung dịch Y, thu được 39,7 gam kết tủa. Giá trị của m là
 Xem đáp án
Xem đáp án
Đáp án B
Ta có:
Câu 33:
Dung dịch X gồm 0,02 mol Cu(NO3)2 và 0,1 mol H2SO4. Khối lượng Fe tối đa phản ứng được với dung dịch X là (biết NO là sản phẩm khử duy nhất của NO3-)
 Xem đáp án
Xem đáp án
Đáp án B
Phân tích: Đây là bài tập rất hay, nếu không nắm vững kiến thức sẽ chọn sai đáp án, cả 3 phương án nhiễu đề có vẻ đúng cho mỗi trường hợp sai, bạn đọc tham khảo 5 hướng giải sai và 2 cách giải đúng sau đây:
Hướng giải sai 1:
Hướng giải sai 2: Quên phản ứng của Fe với Cu2+ và H+ còn dư sau phản ứng (1)
=> chọn đáp án sai là D.
Hướng giải sai 3: Quên phản ứng của Fe với H+ còn dư sau phản ứng (1)
=> chọn đáp án sai là C.
Hướng giải sai 4: Để Fe tối đa thì phản ứng tạo muối Fe2+ ở (1)
=> chọn đáp án sai là C.
Hướng giải sai 5: Ở phản ứng (1) tạo muối Fe3+ thì => Fe không phải tối đa
nH+ dư sau phản ứng (1) =
=> Chọn đáp án sai là A.
Hướng giải đúng 6: Để Fe tối đa thì phản ứng tạo muối Fe2+ ở (1)
nH+ dư sau phản ứng (1) = 0,2-0,16=0,04 mol
=> chọn đáp án đúng là B
Hướng giải đúng 7: Để Fe tối đa thì phản ứng tối đa với (H+ và NO3-), Cu2+, H+ tạo ra muối Fe2+
- Vì => NO3- hết
-
- Dễ thấy trong Y luôn có
Câu 34:
Tiến hành phản ứng nhiệt nhôm với Fe2O3 trong điều kiện không có không khí. Chia hỗn hợp sau phản ứng thành hai phần. Phần một có khối lượng 67 gam cho tác dụng với dung dịch NaOH dư, thu được 16,8 lít H2 (đktc). Hòa tan phần hai bằng dung dịch HCl dư, thu được 84 lít H2 (đktc). Biết các phản ứng xảy ra hoàn toàn. Khối lượng Fe thu được trong quá trình nhiệt nhôm là
 Xem đáp án
Xem đáp án
Đáp án A
Hỗn hợp rắn gồm Al, Al2O3, Fe với
Chia thành 2 phần không bằng nhau:
Câu 35:
Cho ba este đều no, mạch hở, không chứa nhóm chức khác và . Đun nóng hỗn hợp E chứa X, Y, Z với dung dịch NaOH vừa đủ, thu được một ancol T và hỗn hợp F chứa hai muối A, B có tỉ lệ mol tương ứng là 5 : 3 . Dẫn toàn bộ T qua bình đựng Na dư thấy khối lượng bình tăng 12 gam và đồng thời thu được 4,48 lít H2 (đktc). Đốt cháy toàn bộ F, thu đươc Na2CO3, H2O và 7,84 lít CO2 (đktc). Số nguyên tử hidro có trong một phân tử X là
 Xem đáp án
Xem đáp án
Đáp án B
Ta có:
. Vì 2 muối có tỉ lệ mol là 5 : 3 suy ra A: 0,25 mol và B: 0,15 mol
Khi đốt cháy F thì
X, Y, Z lần lượt là => X có 6H.
Câu 36:
Hỗn hợp E gồm chất X (C3H10N2O4) và chất Y (C3H12N2O3), biết X là muối của axit hữu cơ đa chức, Y là muối của axit vô cơ. Cho m gam E tác dụng với dung dịch NaOH (dư, đun nóng), thu được 0,06 mol hai chất khí (có tỉ lệ mol 1 : 5) và dung dịch chứa 3,46 gam muối. Giá trị của m là
 Xem đáp án
Xem đáp án
Đáp án C
Gọi a và b lần lượt là số mol của X và Y. Khi cho E tác dụng với NaOH thì:
Ta có
Câu 37:
Hòa tan hết 45,6342 gam hỗn hợp rắn X gồm FeCl3, Fe(NO3)2, Cu(NO3)2 và Fe3O4 trong dung dịch chứa 1,3984 mol HCl, thu được dung dịch Y chỉ chứa ba muối và 0,0456 mol khí NO (sản phẩm khử duy nhất của N+5). Cho dung dịch AgNO3 dư vào Y, thu được 219,9022 gam kết tủa. Phần trăm số mol của FeCl3 trong X có giá trị gần nhất với giá trị nào sau đây?
 Xem đáp án
Xem đáp án
Đáp án D
Ta có:
Đặt số mol FeCl3, Fe(NO3)2, Cu(NO3)2 lần lượt là x, y, z =>
Dung dịch sau cùng khi cho tác dụng với AgNO3 vừa đủ là
Kết tủa gồm
Từ (1), (2), (3) suy ra:
Câu 38:
Điện phân dung dịch chứa m gam hỗn hợp gồm Cu(NO3)2 và KCl bằng điện cực trơ, màng ngăn xốp với cường độ dòng điện không đổi. Sau thời gian t giây, ở anot thoát ra 2,688 lít hỗn hợp khí (đktc). Nếu thời gian điện phân là 2t giây, thể tích khí thoát ra ở anot gấp 3 lần thể tích khí thoát ra ở catot (đo cùng điều kiện), đồng thời khối lượng catot tăng 18,56 gam. Giá trị của m là
 Xem đáp án
Xem đáp án
Đáp án B
Tại t (s) có khí Cl2 (x mol) và O2 (y mol) thoát ra
Tại 2t (s) có
+ Tại anot có khí Cl2 (x mol) và O2 (z mol)
+ Tại catot có khí H2 thoát ra với
Từ (1), (2), (3) suy ra:
Câu 39:
Hỗn hợp E gồm X, Y và Z là 3 peptit đều mạch hở . Đốt cháy 0,16 mol X hoặc Y hoặc Z đều thu được số mol CO2 lớn hơn số mol H2O là 0,16 mol. Đun nóng 69,8 gam hỗn hợp E chứa X, Y và 0,16 mol Z với dung dịch NaOH vừa đủ, thu được dung dịch chỉ chứa 101,04 gam hai muối của alanin và valin. Phần trăm khối lượng của Z trong E có giá trị gần nhất với giá trị nào sau đây?
 Xem đáp án
Xem đáp án
Đáp án D
X, Y, Z được tạo ra từ Ala và Val đều là amino axit đơn, no, mạch hở.
Khi đốt cháy thì:
=> X, Y, Z đều là peptit.
Khi cho E tác dụng với NaOH thì:
Ta có:
Vì => Val không có ở tất cả 3 peptit => Z không có Val.
Có: => Số mắt xích Val trung bình trong X và Y là 2.
Vì => số mắt xích Val trong X lớn hơn.
+ X có 3 Val, Y có 1 Val => (loại) vì
+ X có 4 Val, Y có 1 Val => (thỏa mãn) => Z là (Ala)4: 0,16 mol
Câu 40:
Cho 33,4 gam hỗn hợp chất rắn X gồm Mg, MgO, Fe(NO3)2 và FeCO3 vào dung dịch chứa 1,29 mol HCl và 0,166 HNO3, sau khi các phản ứng xảy ra hoàn toàn, thu được dung dịch Y chỉ chứa các muối và 0,163 mol hỗn hợp khí Z gồm N2O, N2 và 0,1 mol CO2. Cho dung dịch AgNO3 dư vào Y, thu được 191,595 gam kết tủa. Mặt khác, để tác dụng tối đa với cấc chất trong dung dịch Y cần 1,39 mol KOH trong dung dịch. Biết rằng tổng số mol nguyên tử oxi có trong X là 0,68 mol. Số mol của N2 có trong Z là
 Xem đáp án
Xem đáp án
Đáp án B
Sơ đồ phản ứng:
Khi cho Y tác dụng với AgNO3 dư thì hỗn hợp kết tủa chứa:
. Dung dịch Y chứa:
Khi cho 1,39 mol KOH tác dụng với Y thì dung dịch thu được chứa K+; Cl- và NO3-, có:
và
Ta có:
