[Năm 2022] Đề minh họa môn Hóa THPT Quốc gia có lời giải (25 đề)
[Năm 2022] Đề minh họa môn Hóa THPT Quốc gia có lời giải (Đề 9)
-
4996 lượt thi
-
40 câu hỏi
-
50 phút
Danh sách câu hỏi
Câu 1:
Khi đun nóng chất X có công thức phân tử C3H6O2 với dung dịch NaOH thu được CH3COONa. Công thức cấu tạo của X là
 Xem đáp án
Xem đáp án
Chọn đáp án A. CH3COOCH3.
Câu 3:
Chất nào dưới đây thuộc loại cacbohiđrat?
 Xem đáp án
Xem đáp án
Chọn đáp án D. Glucozơ.
Glucozơ thuộc loại cacbohidrat
Câu 4:
Dung dịch nào sau đây không làm đổi màu quỳ tím?
 Xem đáp án
Xem đáp án
Chọn đáp án D. NH2CH2COOH.
HCl làm quỳ tím hóa đỏ.
NaOH và CH3NH2 làm quỳ tím hóa xanh
NaOH và CH3NH2 làm quỳ tím hóa xanh
Câu 5:
Số nguyên tử hiđro trong phân tử alanin là
 Xem đáp án
Xem đáp án
Chọn đáp án B. 7.
Alanin: H2NCH(CH3)COOH. => Có 7H
Câu 6:
Phân tử polime nào sau đây chứa nhóm -COO-?
 Xem đáp án
Xem đáp án
Chọn đáp án C. Poli(metyl metacrylat).
Câu 7:
Vẻ sáng lấp lánh của các kim loại dưới ánh sáng Mặt Trời (do kim loại có khả năng phản xạ hầu hết những tia sáng khả kiến) được gọi là
 Xem đáp án
Xem đáp án
Chọn đáp án B. ánh kim.
Vẻ sáng lấp lánh của các kim loại dưới ánh sáng Mặt Trời (do kim loại có khả năng phản xạ hầu hết những tia sáng khả kiến) được gọi là ánh kim.
Câu 8:
Dãy các kim loại nào dưới đây được sắp xếp theo chiều giảm dần tính khử?
 Xem đáp án
Xem đáp án
Chọn đáp án A. Mg, Cu, Ag.
Câu 9:
Cơ sở của phương pháp điện phân nóng chảy là
 Xem đáp án
Xem đáp án
Chọn đáp án C. khử ion kim loại trong hợp chất nóng chảy bằng dòng điện một chiều.
Câu 14:
Phương trình hóa học nào dưới đây không đúng ?
 Xem đáp án
Xem đáp án
Chọn đáp án C. BaSO4 Ba + SO2 + O2.
BaSO4 không bị phân hủy thành Ba, SO2, O2 (trong chương trình THPT BaSO4 không bị phân hủy)
Câu 15:
Thu được kim loại nhôm khi
 Xem đáp án
Xem đáp án
Chọn đáp án D. điện phân nóng chảy hỗn hợp Al2O3 với criolit.
Điện phân nóng chảy hỗn hợp Al2O3 với criolit là phương pháp sản xuất Al trong công nghiệp.
Với nguyên liệu là quặng boxit, thêm criolit Na3AlF6 để hạ nhiệt độ nóng chảy của Al2O3 từ 2050oC xuống 900oC, tăng độ dẫn điện do tạo thành nhiều ion hơn, tạo lớp bảo vệ không cho O2 phản ứng với Al nóng chảy.
Với nguyên liệu là quặng boxit, thêm criolit Na3AlF6 để hạ nhiệt độ nóng chảy của Al2O3 từ 2050oC xuống 900oC, tăng độ dẫn điện do tạo thành nhiều ion hơn, tạo lớp bảo vệ không cho O2 phản ứng với Al nóng chảy.
Câu 18:
Một số loại khẩu trang y tế chứa chất bột màu đen có khả năng lọc không khí. Chất đó là
 Xem đáp án
Xem đáp án
Chọn đáp án D. than hoạt tính.
Than hoạt tính màu đen có khả năng lọc không khí
Câu 21:
Cho các este sau: etyl axetat, propyl axetat, metyl propionat, metyl metacrylat. Có bao nhiêu este thủy phân ra cùng một muối?
 Xem đáp án
Xem đáp án
Chọn đáp án C. 2.
Câu 22:
Thủy phân hoàn toàn CH3COOC2H5 và CH2=CHCOOC2H5 trong dung dịch NaOH đều thu được
 Xem đáp án
Xem đáp án
Chọn đáp án A. C2H5OH.
Câu 23:
Tinh thể chất rắn X không màu, vị ngọt, dễ tan trong nước. X có nhiều trong mật ong nên làm cho mật ong có vị ngọt sắc. Trong công nghiệp, X được điều chế bằng phản ứng thủy phân chất Y. Tên gọi của X và Y lần lượt là
 Xem đáp án
Xem đáp án
Chọn đáp án D. Fructozơ và saccarozơ.
Câu 24:
Thủy phân hoàn toàn 34,2 gam saccarozơ trong 200 ml dung dịch HCl 0,1M thu được dung dịch X. Trung hòa dung dịch X (bằng NaOH), thu được dung dịch Y, sau đó cho toàn bộ Y tác dụng với lượng dư dung dịch AgNO3 trong NH3, thu được m gam kết tủa. Giá trị của m là
 Xem đáp án
Xem đáp án
Chọn đáp án B. 46,07.
Ta có:
Quá trình phản ứng:
Quá trình phản ứng:
BTNT Cl:
Câu 25:
Đốt cháy hoàn toàn 0,1 mol một amin no, mạch hở X bằng oxi vừa đủ thu được 0,5 mol hỗn hợp Y gồm khí và hơi. Cho 4,6 gam X tác dụng với dung dịch HCl (dư), số mol HCl phản ứng là:
 Xem đáp án
Xem đáp án
Chọn đáp án B. 0,2.
Dồn X về
Vậy amin phải là:
Câu 26:
Phát biểu nào sau đây đúng?
 Xem đáp án
Xem đáp án
Chọn đáp án D. PVC được điều chế bằng phản ứng trùng hợp.
PVC được trùng hợp từ vinyl clorua CH2=CHCl
Câu 27:
Hòa tan hoàn toàn 3,9 gam hỗn hợp (X) gồm Mg và Al vào một lượng vừa đủ dung dịch HCl, sau phản ứng thu được 4,48 lít H2 (đktc) và dung dịch X. Khối lượng Al có trong hỗn hợp (X) là:
 Xem đáp án
Xem đáp án
Chọn đáp án A. 2,7 gam.
Đặt a, b là số mol Mg, Al
Câu 28:
Hoà tan hoàn toàn m gam Al vào dung dịch NaOH dư, thu được 3,36 lít khí (đktc). Giá trị của m là:
 Xem đáp án
Xem đáp án
Chọn đáp án B. 2,70.
Câu 29:
Phản ứng giữa cặp chất nào dưới đây không thể sử dụng để điều chế các muối Fe(II)?
 Xem đáp án
Xem đáp án
Chọn đáp án C. FeCO3 + HNO3 loãng.
Thu được muối Fe (II)
Thu được muối Fe (II)
-> Thu được muối Fe (III).
Thu được muối Fe (II)
Câu 31:
Đốt cháy hoàn toàn 0,06 mol hỗn hợp X gồm ba chất béo cần dùng 4,77 mol O2, thu được 56,52 gam nước. Mặt khác hiđro hóa hoàn toàn 78,9 gam X trên bằng lượng H2 vừa đủ (xúc tác Ni, t°), lấy sản phẩm tác dụng với dung dịch KOH vừa đủ, thu được x gam muối. Giá trị của x là
 Xem đáp án
Xem đáp án
Chọn đáp án D. 86,10.
Với 0,06 mol X
Ứng với 78,9 gam X
Câu 32:
Tiến hành thí nghiệm phản ứng xà phòng hoá theo các bước sau đây:
Bước 1: Cho vào bát sứ nhỏ khoảng 1 gam mỡ động vật và 2-2,5 ml dung dịch NaOH 40%.
Bước 2: Đun hỗn hợp sôi nhẹ khoảng 8 – 10 phút và liên tục khuấy đều bằng đũa thuỷ tinh. Thỉnh thoảng thêm vài giọt nước cất để giữ cho thể tích của hỗn hợp không đổi.
Bước 3: Rót thêm vào hỗn hợp 4 – 5 ml dung dịch NaCl bão hoà nóng, khuấy nhẹ. Để nguội.
Phát biểu nào sau đây sai?
 Xem đáp án
Xem đáp án
Chọn đáp án C. Mục đích chính của việc thêm nước cất trong quá trình tiến hành thí nghiệm để tránh nhiệt phân muối của các axit béo.
Câu 33:
Cho các phát biểu sau:
(a) Ở điều kiện thường, metylamin là chất khí mùi khai khó chịu, độc, dễ tan trong nước.
(b) Anilin là chất lỏng ít tan trong nước.
(c) Dung dịch anilin làm đổi màu phenolphtalein.
(d) Khi nấu canh cua, hiện tượng riêu cua nổi lên trên là do sự đông tụ protein.
(e) Đipeptit Ala-Val có phản ứng màu biure.
Số phát biểu đúng là
 Xem đáp án
Xem đáp án
Chọn đáp án C. 3.
(3) Sai, Dung dịch anilin không làm đổi màu phenolphtalein.
(5) Sai, Đipeptit Ala-Val không có phản ứng màu biure.
(5) Sai, Đipeptit Ala-Val không có phản ứng màu biure.
Câu 34:
Hỗn hợp M gồm axit cacboxylic X, ancol Y (đều đơn chức, số mol X gấp hai lần số mol Y) và este Z được tạo ra từ X và Y. Cho một lượng M tác dụng vừa đủ với dung dịch chứa 0,2 mol NaOH, tạo ra 16,4 gam muối và 8,05 gam ancol. Công thức của X và Y là
 Xem đáp án
Xem đáp án
Chọn đáp án D. CH3COOH và C2H5OH.
Gọi X là RCOOH, Y là R'OH => Z là RCOOR'
Đặt nX = 2x => nY = x => nZ = y
nNaOH = 0,2 => 2x + y = 0,2
m muối = 16,4 => nRCOONa = ; mà nRCOONa = nNaOH = 0,2
=> R =15 (CH3-)
nR'OH = => x + y =
Rõ ràng +) 2x + y < 2x + 2y => 0,2 < 2. => R' < 63,5
+) x + y < 2x + y => 0,2 > => R' > 23,25
=> R' = 29 (C2H5-) ; 43 (C3H7-) ; 59(C4H9-)
Câu 35:
Đốt cháy hoàn toàn m gam hỗn hợp gồm hai amin (đơn chức, thuộc cùng dãy đồng đẳng) và hai anken cần vừa đủ 0,2775 mol O2, thu được tổng khối lượng CO2 và H2O bằng 11,43 gam. Giá trị lớn nhất của m là:
 Xem đáp án
Xem đáp án
Chọn đáp án B. 2,97.
Ta có:
Dồn hỗn hợp về dễ dàng suy ra m lớn nhất khi x = 1
Giá trị của m lớn nhất khi
Câu 36:
Hấp thụ hoàn toàn 1,568 lít CO2 (đktc) vào 500 ml dung dịch NaOH 0,16M thu được dịch X. Thêm 250 ml dung dịch Y gồm BaCl2 0,16M và Ba(OH)2 a mol/l vào dung dịch X thu được 3,94 gam kết tủa và dung dịch Z. Giá trị của a là:
 Xem đáp án
Xem đáp án
Chọn đáp án A. 0,02.
Câu 37:
Hỗn hợp X gồm: Na, Ca, Na2O và CaO. Hoàn tan hết 5,13 gam hỗn hợp X vào nước thu được 0,56 lít H2 (đktc) và dung dịch kiềm Y trong đó có 2,8 gam NaOH. Hấp thụ 1,792 lít khí SO2 (đktc) vào dung dịch Y thu được m gam kết tủa. Giá trị của m là:
 Xem đáp án
Xem đáp án
Chọn đáp án A. 7,2.
Câu 38:
Thực hiện các thí nghiệm sau:
(1) Cho dung dịch HCl dư vào ống nghiệm chứa dung dịch NaAlO2.
(2) Dần khí CO2 dư vào ống nghiệm chứa dung dịch NaAlO2.
(3) Cho dung dịch Ba(OH)2 dư vào ống nghiệm chứa dung dịch Al2(SO4)3.
(4) Cho dung dịch NH3 dư vào ống nghiệm chứa dung dịch Al2(SO4)3.
(5) Cho dung dịch AgNO3 vào ống nghiệm chứa dung dịch HCl.
(6) Cho nước cứng vĩnh cửu tác dụng với dung dịch Na3PO4.
Sau khi các phản ứng xảy ra hoàn toàn, số thí nghiệm thu được kết tủa là
 Xem đáp án
Xem đáp án
Chọn đáp án D. 5.
- Thí nghiệm (1) kết tủa tạo ra rồi tan hết: 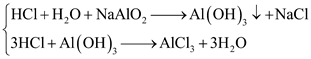

- Các thí nghiệm thu được kết tủa là: (2), (3), (4), (5), (6).
(2)
(3)
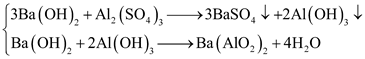
(4)
(5)
(6) Nước cứng vĩnh cửu chứa Ca2+ và 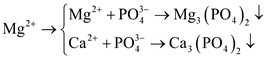
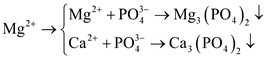
Câu 39:
X, Y, Z là 3 este đều đơn chức, mạch hở (trong đó Y và Z không no, chứa 1 liên kết đôi C=C và có tồn tại đồng phân hình học). Đốt cháy hoàn toàn 21,62 gam hỗn hợp E chứa X, Y, Z với oxi vừa đủ, dẫn toàn bộ sản phẩm cháy qua dung dịch Ca(OH)2 dư thấy khối lượng dung dịch giảm 34,5 gam so với trước phản ứng. Mặt khác, đun nóng 21,62 gam E với 300 ml dung dịch NaOH 1M (vừa đủ) thu được hỗn hợp F chỉ chứa 2 muối và hỗn hợp gồm 2 ancol kế tiếp nhau trong cùng dãy đồng đẳng. Khối lượng của muối có khối lượng phân tử lớn trong hỗn hợp F là
 Xem đáp án
Xem đáp án
Chọn đáp án B. 8,64 gam.
Đặt
Sơ đồ phản ứng:
Câu 40:
Hòa tan hoàn toàn 16,4 gam hỗn hợp X chứa Mg, MgO và Fe3O4 (trong X oxi chiếm 22,439% về khối lượng) bằng dung dịch chứa HNO3 và 0,835 mol HCl thu được dung dịch Y chỉ chứa hỗn hợp 3 muối và 0,05 mol khí NO (duy nhất). Phần trăm khối lượng của Mg trong X gần nhất với:
 Xem đáp án
Xem đáp án
Chọn đáp án C. 22%.
Ta có: . Gọi
Tư duy phá vỡ gốc NO3-
