Tổng hợp đề thi thử THPTQG Hóa học mức độ cơ bản nâng cao (đề số 6)
-
5548 lượt thi
-
49 câu hỏi
-
60 phút
Danh sách câu hỏi
Câu 1:
Hòa tan hết 8 gam hỗn hợp X gồm Fe và Mg bằng dung dịch H2SO4 loãng, dư thu được 4,48 lít khí H2 ở đktc. Phần trăm khối lượng của Fe trong hỗn hợp X là
 Xem đáp án
Xem đáp án
Đáp án B
Câu 3:
Cho dãy các chất: Fe(NO3)2; CuCl2; MgCO3; BaSO4. Số chất trong dãy phản ứng được với dung dịch NaOH là
 Xem đáp án
Xem đáp án
Đáp án A
Fe(NO3)2 và CuCl2
Câu 4:
Thạch cao nung được dùng để đúc tượng, bó bột khi gãy xương. Công thức phân tử của thạch cao nung là
 Xem đáp án
Xem đáp án
Đáp án C
Câu 6:
Nung m gam Mg(NO3)2 đến khi phản ứng xảy ra hoàn toàn thu được 5,6 lít (đktc) hỗn hợp khí X gồm NO2 và O2. Giá trị của m là
 Xem đáp án
Xem đáp án
Đáp án A
Đặt số mol O2 là a à Số mol NO2 là 4a; số mol Mg(NO3)2 = 2a
Theo bài ra ta có: 5a = 0,25 à a = 0,05 à số mol Mg(NO3)2 = 0,1
à Khối lượng Mg(NO3)2 = 14,8 gam
Câu 10:
Đốt cháy hoàn toàn một ancol no, đơn chức, mạch hở X thu được 3,6 gam H2O và 4,4 gam CO2. Tên gọi theo danh pháp thay thế của X là
 Xem đáp án
Xem đáp án
Đáp án C
nCO2 = 0,1 mol ; nH20 = 0,2 mol
=> nC : nH = 0,1 : 0,4 =1 : 4
=> chỉ có thể là ancol CH4O (CH3OH)
Câu 11:
Để điều chế oxi trong phòng thí nghiệm, người ta nhiệt phân muối kaliclorat (xt: MnO2). Công thức phân tử của muối kalicorat là
 Xem đáp án
Xem đáp án
Đáp án B
Câu 13:
Chất nào dưới đây không có khả năng tham gia phản ứng tráng gương?
 Xem đáp án
Xem đáp án
Đáp án A
Chất có nhóm CHO mới có khả năng tham gia phản ứng tráng guơng
Câu 14:
Yếu tố nào dưới đây không làm ảnh hưởng đến chuyển dịch cân bằng hóa học?
 Xem đáp án
Xem đáp án
Đáp án B
Câu 15:
Tổng số nguyên tử hiđro trong một phân tử axit glutamic là
 Xem đáp án
Xem đáp án
Đáp án D
Axit glutamic : HOOC-(CH2)2-CH(NH2)-COOH
Câu 17:
Cho các chất sau: Al; Fe; Fe3O4; Fe2O3; Cr; Sn; Fe(OH)3 lần lượt tác dụng với dung dịch HCl thì số chất chỉ cho sản phẩm muối clorua có dạng MCl3 là
 Xem đáp án
Xem đáp án
Đáp án B
Al; Fe2O3; Fe(OH)3
Câu 18:
Xà phòng hóa hoàn toàn 7,4 gam một este no, đơn chức, mạch hở X cần dùng vừa đủ 100ml dung dịch NaOH 1M. Số công thức cấu tạo của X là
 Xem đáp án
Xem đáp án
Đáp án B
Số mol NaOH = 0,1 (mol) à Số mol este = 0,1 (mol) à Meste = 74
à CTPT của este: C3H6O2
à X có 2 CTCT este:
Câu 19:
Cho m gam anđehit axetic tác dụng với lượng dư dung dịch AgNO3 trong NH3 thu được 32,4 gam Ag kim loại. Giá trị của m là
 Xem đáp án
Xem đáp án
Đáp án B
CH3CHO à 2Ag
=> nCH3CHO = 1/2 nAg = m = 6,6g
Câu 20:
Cấu hình electron lớp ngoài cùng của các kim loại nhóm IIA (kim loại kiềm thổ) có dạng
 Xem đáp án
Xem đáp án
Đáp án D
Câu 22:
Chất nào dưới đây vừa phản ứng được với dung dịch HCl vừa phản ứng được với dung dịch NaOH?
 Xem đáp án
Xem đáp án
Đáp án A
Câu 23:
Hòa tan hoàn toàn 5,6 gam kim loại M (hóa trị II) trong dung dịch HNO3 đặc, nóng, dư thu được 3,92 lít khí NO2 (sản phẩm khử duy nhất ở đktc). Kim loại M là
 Xem đáp án
Xem đáp án
Đáp án D
Bảo toàn e : 2nM = nNO2 => nM = 0,0875 mol
=> Mkimloại = 64g => Kim loại cần tìm là Cu
Câu 25:
Tổng số liên kết σ (xích ma) trong một phân tử vinyl axetilen là
 Xem đáp án
Xem đáp án
Đáp án B
CTPT của vinyl axetilen: C4H4 à Số liên kết s = 7
Câu 27:
Chất nào dưới đây là chất lưỡng tính?
 Xem đáp án
Xem đáp án
Chọn đáp án C
Chất lưỡng tính là chất vừa tác dụng với dung dịch axit vừa tác dụng với dung dịch bazơ.
⇒ Zn(OH)2 là chất lưỡng tính.
Zn(OH) + 2HCl ⟶ ZnCl2 + 2H2O
Zn(OH)2 + 2NaOH ⟶ Na2ZnO2 + 2H2O
Câu 28:
Cho 6,75 gam một amin no, đơn chức, mạch hở X tác dụng với dung dịch HCl dư thì thu được 12,225 gam muối. Công thức phân tử của X là
 Xem đáp án
Xem đáp án
Đáp án C
Bảo toàn khối lượng : mX + mHCl = mmuối
=> nHCl = nX = 0,15 mol
=> Mamin = 45g => amin là C2H7N
Câu 29:
Dung dịch nào dưới đây dùng để phân biệt dung dịch KCl với dung dịch K2SO4?
 Xem đáp án
Xem đáp án
Đáp án D
K2SO4 + BaCl2 tạo kết tủa BaSO4
Còn KCl không phản ứng với BaCl2
Câu 30:
Đốt cháy hoàn toàn 0,5 mol hỗn hợp anken A và ankin B thu được 44 gam CO2. Tên gọi của A và B lần lượt là
 Xem đáp án
Xem đáp án
Đáp án C
nCO2 = 1mol => Số trung bình = 2
=> anken và ankin đều có 2 nguyên tử C trong phân tử
=> C2H4 và C2H2
Câu 31:
Cho a mol Fe phản ứng vừa đủ với b mol H2SO4 (đặc, nóng) thu được khí SO2 (sản phẩm khử duy nhất) và 5,04 gam muối. Biết tỉ lệ a : b = 3 : 7. Giá trị của a là
 Xem đáp án
Xem đáp án
Đáp án A
Muối gồm:
Số mol e nhường = 2x + 6y à Số mol SO2 = x+ 3y
à Số mol H2SO4 phản ứng = 2x + 6y (mol)
Theo bài ra ta có :
Giải (1) và (2) ta được :
Câu 32:
Có các thí nghiệm sau:
(a). Nhỏ dung dịch natri thiosunfat vào dung dịch axit sunfuaric loãng.
(b). Nhỏ anilin vào nước brom.
(c). Sục khí hiđro sunfua vào dung dịch đồng (II) sunfat.
(d). Nhỏ dung dịch sắt (II) nitrat vào dung dịch bạc nitrat .
(e). Sục khí etilen vào dung dịch thuốc tím.
(f). Cho ure vào dung dịch bari clorua dư.
(g). Nhỏ dung dịch natri hiđrocacbonat vào dung dịch bari hiđroxit dư.
(h). Sục khí amoniac tới dư vào dung dịch nhôm clorua.
Số thí nghiệm sinh ra kết tủa là
 Xem đáp án
Xem đáp án
Đáp án D
Các phương trình phản ứng xảy ra
a) Na2S2O3 + H2SO4 à Na2SO4 + SO2 + S¯ + H2O
b) C6H5NH2 + 3Br2 à C6H2Br3NH2¯ + 3HBr
c) H2S + CuSO4 à CuS¯ + H2SO4
d) Fe(NO3)2 + AgNO3 à Fe(NO3)2 + Ag¯
e) 3C2H4 + 24KMnO4 + 4H2O à 3C2H6O2 + 2MnO2 ¯ + 2KOH
f) (NH2)2CO + 2H2O + BaCl2 à BaCO3¯ + 2NH4Cl
g) NaHCO3 + Ba(OH)2 (dư) à BaCO3¯ + NaOH + H2O
h) AlCl3 + 3NH3 + 3H2O à Al(OH)3¯ + 3NH4Cl
Câu 33:
Cho các hợp chất có cấu tạo mạch hở có công thức phân tử lần lượt là: CH4O, CH2O, CH2O2, CH2O3, CH4N2O, CH5NO3, CH8N2O3. Số chất tác dụng được với dung dịch NaOH, đun nóng là
 Xem đáp án
Xem đáp án
Đáp án A
CTCT của các chất lần lượt là
|
CH4O |
CH2O |
CH2O2 |
CH2O3 |
CH4N2O |
CH5NO3 |
CH8N2O3 |
|
CH3OH |
HCHO |
HCOOH |
H2CO3 |
(NH2)2CO |
NH4HCO3 |
(NH4)2CO3 |
à Có 5 chất tác dụng được với dung dịch NaOH: HCOOH; H2CO3; (NH2)2CO; NH4HCO3; (NH4)2CO3.
Câu 34:
Có các thí nghiệm sau được thực hiện ở nhiệt độ thường:
(a). Cho Be vào H2O.
(b). Sục khí F2 vào H2O.
(c). Cho bột Si vào dung dịch NaOH.
(d). Cho bột Al vào dung dịch NaOH.
(e). Cho Sn vào dung dịch HCl.
(f). Nhỏ dung dịch HCl đặc vào dung dịch KMnO4.
Số thí nghiệm sinh ra khí H2 sau phản ứng là
 Xem đáp án
Xem đáp án
Đáp án B
Các phương trình phản ứng xảy ra
(c). Si + 2NaOH + H2O à Na2SiO2 + 2H2
(d). 2Al + 2NaOH + 2H2) à 2NaAlO2 + 3H2
(e). Sn + HCl à SnCl2 + H2
Câu 35:
A, B, C là các kim loại chuyển tiếp và đều thuộc chu kỳ 4 trong bảng tuần hoàn (ZA < ZB < ZC). Biết rằng tổng số electron lớp ngoài cùng của A, B và C bằng 4; tổng số electron ở lớp ngoài cùng và phân lớp sát ngoài cùng của B là 8. Điều khẳng định nào sau đây về A, B, C là đúng?
 Xem đáp án
Xem đáp án
Đáp án A
Cấu hình electron của A, B, C có dạng: [Ar] 3dα4sa4pb
Do tổng số electron lớp ngoài cùng của A, B, C = 4 nên phải có hai nguyên tố có cấu hình eletron lớp ngoài cùng dạng 4s1 và một nguyên tố còn lại là 4s2
Vì B có tổng số electron ở lớp ngoài cùng và phân lớp sát ngoài cùng là 8 nên B có cấu hình: [Ar]3d64s2
Vậy A là: [Ar]3d54s1 và C là: [Ar]3d104s1 à A: 24Cr; B: 26Fe; C:29Cu
Câu 36:
Hợp chất hữu cơ X có công thức phân tử C8H8O2, X chứa nhân thơm, khi cho 0,1 mol X tác dụng vừa đủ với dung dịch chứa 0,2 mol NaOH. Số đồng phân cấu tạo của X thỏa mãn là
 Xem đáp án
Xem đáp án
Đáp án D
X: C8H8O2 (Δ = 5) ; X chứa nhân thơm
X tác dụng với NaOH theo tỉ lệ 1 : 2 nên X là este của phenol hoặc X có 2 nhóm –OH trên vòng.
Các CTCT của X:

Câu 37:
Trong thành phần phân tử của ancol X có nC = nO. Điều khẳng định nào sau đây về X là đúng?
 Xem đáp án
Xem đáp án
Đáp án A
Ancol có số mol C = số mol O là ancol có số nguyên tử cacbon bằng số nguyên tử O
=> ancol phản là ancol no
Câu 38:
Cho 12,6 gam hỗn hợp X gồm Al và Al4C3 vào dung dịch KOH dư, sau khi các phản ứng xảy ra hoàn toàn thu được a mol hỗn hợp khí Y và dung dịch Z. Sục khí CO2 dư vào dung dịch Z thu được 31,2 gam kết tủa. Giá trị của a là
 Xem đáp án
Xem đáp án
Đáp án D
Đặt số mol Al: x(mol); Al4C3: y(mol) ta có: 27x + 144y = 12,6 (1)
Kết tủa thu được là Al(OH)3. Số mol Al(OH)3 = 0,4 (mol) à x + 4y = 0,4 (BTNT Al) 2
Giải (1) và (2) ta được : x = 0,2 (mol); y = 0,05 (mol)
Khí thu được gồm H2 và CH4; số mol H2 = 1,5x; số mol CH4 = 3y
à Tổng số mol khí = 1,5x + 3y = 0,45 (mol)
Câu 39:
Cho 6,36 gam hỗn hợp X gồm ancol anlylic; propanal và propanđial (trong đó propanđial chiếm 40% số mol). Hiđro hóa hoàn toàn 6,36 gam hỗn hợp X cần V lít khí H2 (Ni, to). Giá trị của V là
 Xem đáp án
Xem đáp án
Đáp án D
Hỗn hợp X
Số mol H2 phản ứng với X = a+ 2b = 0,06 + 0,08 = 0,14 (mol) à V = 3,16 lít
Câu 40:
Điện phân (với điện cực trơ, màng ngăn xốp) dung dịch X chứa CuSO4 và NaCl (có tỉ lệ mol tương ứng 3:2) bằng dòng điện một chiều có cường độ 5A, sau thời gian t giờ thu được dung dịch Y chứa hai chất tan và thấy khối lượng dung dịch Y giảm 33,1 gam so với khối lượng của dung dịch X. Dung dịch Y hòa tan tối đa 3,6 gam Al. Giả sử khí sinh ra trong quá trình điện phân thoát hết ra khỏi dung dịch. Giá trị của t gần giá trị nào nhất sau đây?
 Xem đáp án
Xem đáp án
Đáp án C
Dung dịch Y chứa 2 chất tan nên CuSO4 và NaCl bị điện phân hết. Các ptpt xảy ra:
Cu2+ + 2Cl- à Cu+ Cl2 (1)
2CuSO4 + 2H2O à 2Cu + 2H2SO4 + O2 (2)
2Al + 3H2SO4 à Al2(SO4)3 + 3H2 (3)
Theo các ptpu (3) và (2) thì số mol H2SO4 = số mol CuSO4 = 1,5 nAl = 0,2 (mol)
Theo (1) và giả thiết ta có số mol CuSO4 = 0,3 (mol); số mol NaCl = 0,2 (mol)
Giả sử trong quá trình điện phân H2O chưa bị điện phân thì khối lượng dung dịch giảm = 29,5 < 33,1
Vậy nước bị điện phân; khối lượng nước bị điện phân = 3,6 (gam)
ne trao đổi = 2nCl2 + 4nO2 = 1 (mol)
t = (giờ)
Câu 41:
Hòa tan m gam Mg trong 500ml dung dịch chứa hỗn hợp H2SO4 0,4M và Cu(NO3)2 đến phản ứng hoàn toàn thu được dung dịch X; 2 gam hỗn hợp kim loại và hỗn hợp khí X gồm 0,03 mol H2 và 0,02 mol N2. Giá trị của m là
 Xem đáp án
Xem đáp án
Đáp án A
Khí X có chứa H2 à dung dịch X không có muố nitrat;
Sau phản ứng thu được hỗn hợp kim loại à Mg dư à H+ đã phản ứng hết
Số mol H+ phản ứng = 0,4 (mol); Số mol H+ tạo ra H2 và N2 = 0,3 à có muối amoni trong dung dịch X
Số mol NH4+ = (mol)à Số mol Cu(NO3)2 (bđ) = 0,025 (mol)
Theo bảo toàn e à số mol Mg phản ứng = 0,195 (mol); khố lượng Mg dư = 0,4 gam
à Khối lượng Mg (ban đầu) = 5,08 gam
Câu 42:
Đun nóng 45,54 gam hỗn hợp E gồm hexapeptit X và tetrapeptit Y cần dùng 580 ml dung dịch NaOH 1M chỉ thu được dung dịch chứa muối natri của glyxin và valin. Mặt khác, đốt cháy cùng lượng E như trên bằng một lượng O2 vừa đủ thu được hỗn hợp Y gồm CO2; H2O và N2. Dẫn toàn bộ Y qua bình đựng dung dịch Ba(OH)2 dư, thấy khối lượng bình tăng 115,18 gam. Phần trăm khối lượng của X trong E gần với giá trị nào nhất sau đây?
 Xem đáp án
Xem đáp án
Đáp án A
Số mol NaOH – 0,58 (mol) à số mol Nitơ trong E = 0,58 à Số mol N2 (phản ứng cháy) = 0,29 (mol). Áp dụng ĐLBTKL ta có mO2 (phản ứng cháy) = 45,54 + mO2 = 115,18=0,29.28
à mO2 = 77,76 (gam)
Quy đổi hỗn hợp E thành đipeptit theo sơ đồ:
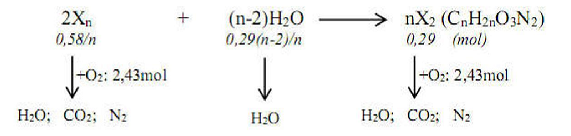
Khi đốt X2 ta có số mol H2O = số mol CO2 ; BTNT (O) ta có : nH2O = nCO2 = 1,91 (mol)
Khi đốt Xn ta có số mol CO2 = 1,91 (mol).
BTKL à mH2O = 31,14 (gam) à nH2O = 1,73 (mol)
E gồm:
Muối gồm:
Đặt công thức của các peptit trong E:
Vậy hỗn hợp E gồm:
Câu 43:
Cho X, Y là hai chất thuộc dãy đồng đẳng của axit acrylic và MX < MY; Z là ancol có cùng số nguyên tử cacbon với X; T là este hai chức tạo bởi X, Y và Z. Đốt cháy hoàn toàn 11,16 gam hỗn hợp E gồm X, Y, Z, T cần vừa đủ 13,216 lít khí O2 (đktc), thu được khí CO2 và 9,36 gam nước. Mặt khác 11,16 gam E tác dụng tối đa với dung dịch chứa 0,04 mol Br2. Khối lượng muối thu được khi cho cùng lượng E trên tác dụng hết với dung dịch KOH dư là
 Xem đáp án
Xem đáp án
Đáp án C
BTKL cho phản ứng cháy ta có khối lượng CO2 = 20,68 gam à Số mol CO2 = 0,47 (mol)
Do số mol H2O > số mol CO2 nên ancol là ancol no, 2 chức
Đặt công thức của các chất trong hỗn hợp E:
BTNT (O) ta có: 2x + 2y +4z = 0,28 (1)
E phản ứng tối đa với 0,04 mol Br2 nên : x + 2z = 0,04 (2)
Từ sự chênh lệch số mol H2O và CO2 ta có: y – x – 3z = 0,05 (3)
Giải hệ (1); (2); (3) ta có: x= 0,02; y= 0,1; z = 0,01
Số nguyên tử cacbon trung bình (E) = 3,61 à X là CH2=CH-COOH à Ancol : C3H8O2
Khối lượng của axit và este trong E = 11,16 – 76.0,1 = 3,56 (gam)
Ta có sơ đồ:
BTKL ta có: mmuối = 4,68 gam
Câu 44:
Hỗn hợp X chứa ba axit cacboxylic đều đơn chức, mạch hở, gồm một axit no và hai axit không no đều có một liên kết đôi (C=C). Cho m gam X tác dụng vừa đủ với 150 ml dung dịch NaOH 2M, thu được 25,56 gam hỗn hợp muối. Đốt cháy hoàn toàn m gam X, hấp thụ toàn bộ sản phẩm cháy bằng dung dịch NaOH dư, khối lượng dung dịch tăng thêm 40,08 gam. Tổng khối lượng của hai axit cacboxylic không no trong m gam X là
 Xem đáp án
Xem đáp án
Đáp án D
Số mol NaOH = 0,3 (mol) à Số mol O (axit) = 0,6 (mol)
BTKL ta có mX = 18,96 (gam)
Đặt số mol CO2 : x(mol); số mol H2O : y(mol)
Ta có hệ pt:
à Số mol axit không no = 0,15 ; số mol axit no = 0,15
à Số nguyên tử cacbon trung bình = 2,3; số nguyên tử hiđro trung bình = 3,6 à Có HCOOH
Vậy khối lượng của 2 axit không no trong hỗn hợp X = 18,96 – 0,15.46 = 12,06 (gam)
Câu 45:
X là chất hữu cơ không tác dụng với Na. Thủy phân X trong dung dịch NaOH chỉ tạo ra một muối của α-amino axit (mạch cacbon không phân nhánh, chứa 1 nhóm amino và 2 nhóm cacboxyl) và một ancol no đơn chức. Thủy phân hoàn toàn một lượng chất X trong 100ml NaOH 1M rồi cô cạn, thu được 1,84 gam một ancol Y và 6,22 gam chất rắn khan Z. Đun nóng 1,84 gam ancol Y với H2SO4 đặc ở 170oC thu được 0,672 lít (đktc) một olefin với hiệu suất phản ứng là 75%. Cho toàn bộ chất rắn Z tác dụng với dung dịch HCl dư rồi cô cạn thì thu được chất rắn khan R. Quá trình cô cạn không xảy ra phản ứng. Khối lượng của chất rắn R là
 Xem đáp án
Xem đáp án
Đáp án A
X là este có dạng: ROOC-R'(NH2)-COOR
Số mol của olefin = 0,03 à Số mol của anol = 0,04 (nol) à Mancol = 46.
Số mol của X = 0,02 (mol) à Chất rắn Z gồm:
à Khối lượng của muối hữu cơ = 3,82 gam à Mmuối = 191 à R' = 41 −C3H5)
Cho Z tác dụng với HCl dư thu được chất rắn khan R gồm:
à mchất rắn = 183,5.0,02 + 58,5.0,1 = 9,52 (gam)
Câu 46:
Cho m gam Al tan hoàn toàn vào dung dịch chứa y mol HCl thu được dung dịch Z chứa 2 chất tan có cùng nồng độ mol. Thêm từ từ dung dịch NaOH vào dung dịch Z thì đồ thị biểu diễn lượng kết tủa phụ thuộc vào lượng OH- như sau:
Giá trị của m là
 Xem đáp án
Xem đáp án
Đáp án B
Dung dịch Z gồm:
Theo sơ đồ khi cho 5,16 mol NaOH vào dung dịch Z thì xảy ra 3 phản ứng và thu được 0,7x mol Al(OH)3
à Số mol NaAlO2 = 0,3x mol
à x + 3.0,7x + 4.0,3x =5,16 à x = 1,2 (mol) à Số mol Alban đầu = 1,2 à m = 32,4 (gam)
Câu 47:
Hỗn hợp X chứa 5 hợp chất hữu cơ no, mạch hở, có số mol bằng nhau, (trong phân tử chỉ chứa nhóm chức –CHO hoặc –COOH hoặc cả 2). Chia X thành 4 phần bằng nhau:
- Phần 1 tác dụng vừa đủ 0,896 lít (đktc) H2 (xt: Ni, to).
- Phần 2 tác dụng vừa đủ 400 ml dung dịch NaOH 0,1M.
- Đốt cháy hoàn toàn phần 3 thu được 3,52 gam CO2.
- Phần 4 tác dụng với AgNO3 dư trong NH3, đun nóng đến phản ứng hoàn toàn thu được m gam Ag. Giá trị của m là
 Xem đáp án
Xem đáp án
Đáp án C
Số mol H2 = 0,04 à số mol nhóm –CHO = 0,04 (mol)
Số mol NaOH = 0,04 à Số mol nhóm –COOH = 0,04 (mol)
Số mol CO2 = 0,08 (mol) = số mol nhóm –CHO + số mol nhóm –COOH
à 1/4 hỗn hợp X gồm các chất:
Câu 48:
Trộn 8,1 gam Al với 35,2 gam hỗn hợp rắn X gồm Fe, FeO, Fe3O4, Fe2O3 và Fe(NO3)2 thu được hỗn hợp Y. Hòa tan hoàn toàn Y vào dung dịch chứa 1,9 mol HCl và 0,15 mol HNO3, khuấy đều cho các phản ứng xảy ra hoàn toàn, thu được dung dịch Z (không chứa muối amoni) và 0,275 mol hỗn hợp khí T gồm NO và N2O. Cho dung dịch AgNO3 đến dư vào dung dịch Z. Sau khi các phản ứng xảy ra hoàn toàn thu được dung dịch M; 0,025 mol khí NO (sản phẩm khử duy nhất của N+5) và 280,75 gam kết tủa. Phần trăm khối lượng của Fe(NO3)2 trong Y là
 Xem đáp án
Xem đáp án
Đáp án A
Sơ đồ 1:
Sơ đồ 2:
Từ sơ đồ 2 ta có:
BTNT Cl à số mol AgCl = 1,9 (mol) à Số mol Ag = 0,075 (mol)
Số mol H+ dư trong Z = 4nNO = 0,1 (mol)
Bảo toàn e ta có số mol Fe2+ (trong Z) = 3nNO + nAg = 0,15 (mol)
Bảo toàn điện tích cho dung dịch Z ta có: Số mol Fe3+ = 0,2 (mol)
Từ sơ đồ 1 ta có:
Số mol H2O =
BTKL ta có: mkhí T = 9,3 (gam) à
BTNT (N) ta có số mol Fe(NO3)2 =
à %m(Fe(NO3)2 =
Câu 49:
Cho 38,55 gam hỗn hợp X gồm Mg, Al, ZnO và Fe(NO3)2 tan hoàn toàn trong dung dịch chứa 0,725 mol H2SO4 loãng. Sau khi các phản ứng xảy ra hoàn toàn, thu được dung dịch Y chỉ chứa 96,55 gam muối sunfat trung hòa và 3,92 lít (đktc) khí Z gồm hai khí trong đó có một khí hóa nâu ngoài không khí. Biết tỉ khối của Z so với H2 là 9. Phần trăm số mol của Mg trong hỗn hợp X là
 Xem đáp án
Xem đáp án
Đáp án C
Hỗn hợp Y gồm
Sơ đồ phản ứng:
BTKL ta có khối lượng H2O = 9,9 (gam) à số mol H2O = 0,55 (mol)
BTNT (H) ta có số mol NH4+ =
BTNT (N) à Số mol Fe(NO3)2 =
BTNT (O) à Số mol ZnO = 0,2 (mol)
Đặt số mol Mg và Al trong X lần lượt là a và b ta có
%
