Đề thi thử THPT Quốc gia môn Hóa năm 2022 chọn lọc, có lời giải (30 đề)
Đề thi thử THPT Quốc gia môn Hóa năm 2022 chọn lọc, có lời giải (Đề 7)
-
6211 lượt thi
-
40 câu hỏi
-
50 phút
Danh sách câu hỏi
Câu 1:
 Xem đáp án
Xem đáp án
Câu 4:
Phèn chua được dùng trong ngành công nghiệp thuộc da, công nghiệp giấy, chất cầm màu trong ngành nhuộm vải, chất làm trong nước. Công thức hoá học của phèn chua là
 Xem đáp án
Xem đáp án
Câu 5:
Hóa chất nào sau đây không làm mềm được nước cứng tạm thời?
 Xem đáp án
Xem đáp án
Câu 8:
Phản ứng este hoá giữa ancol etylic và axit axetic tạo thành este có tên gọi là:
 Xem đáp án
Xem đáp án
Câu 10:
Kết quả thí nghiệm của các dung dịch X, Y, Z, T với thuốc thử được ghi ở bảng sau:
|
Mẫu thử |
Thuốc thử |
Hiện tượng |
|
X |
Quỳ tím |
Chuyển thành màu hồng |
|
Y |
Dung dịch iot |
Hợp chất màu xanh tím |
|
Z |
Dung dịch AgNO3 trong NH3 đun nóng |
Kết tủa Ag trắng |
|
T |
Nước brom |
Kết tủa trắng |
X, Y, Z, T lần lượt là:
 Xem đáp án
Xem đáp án
Câu 14:
 Xem đáp án
Xem đáp án
Câu 17:
Hóa học là một môn khoa học thực nghiệm. Thông qua các bài thực hành để củng cố, khắc sâu kiến thức và gắn lí thuyết với thực tế. Trong giờ thực hành, để tiết kiệm hóa chất và bảo vệ môi trường (đất, nước, không khí), chúng ta không nên làm việc nào sau đây?
 Xem đáp án
Xem đáp án
Câu 19:
Dung dịch chất nào dưới đây làm đổi màu quỳ tím thành xanh?
 Xem đáp án
Xem đáp án
Câu 21:
Phương pháp dùng điều chế các kim loại Na, Ca, Al là
 Xem đáp án
Xem đáp án
Câu 22:
Tiến hành các thí nghiệm sau:
(a) Nhúng thanh đồng nguyên chất vào dung dịch FeCl3.
(b) Để miếng tôn (sắt tráng kẽm) trong không khí ẩm.
(c) Nhúng thanh kẽm vào dung dịch H2SO4 loãng có nhỏ vài giọt dung dịch CuSO4.
(d) Đốt sợi dây sắt trong bình đựng khí oxi.
Trong các thí nghiệm trên, số thí nghiệm xảy ra ăn mòn điện hoá là
 Xem đáp án
Xem đáp án
Chọn B.
Ăn mòn điện hóa xuất hiện khi có cặp điện cực tiếp xúc
với nhau và cùng tiếp xúc với dung dịch điện ly:
(b) Zn-Fe
(c) Zn-Cu
Câu 23:
Cho hỗn hợp gồm 0,2 mol Cu và 0,1 mol Fe3O4 tác dụng với dung dịch HCl dư, sau phản ứng có m gam chất rắn không tan. Giá trị của m là:
 Xem đáp án
Xem đáp án
Chọn A.
Chất rắn không tan là Cu dư
dư = 6,4 gam
Câu 24:
Nhận xét nào sau đây là đúng?
 Xem đáp án
Xem đáp án
Câu 25:
 Xem đáp án
Xem đáp án
Câu 26:
Cho các chất: anđehit fomic, axit axetic, glucozơ. Điều khẳng định không đúng là:
 Xem đáp án
Xem đáp án
Chọn A.
A. Sai, không cộng
B. Đúng
C. Đúng
D. Đúng vì chúng có cùng CTĐGN là
Câu 27:
 Xem đáp án
Xem đáp án
Chọn C.
Oxit Kim loại
Bảo toàn khối lượng: m kim loại
m kim loại = 4,48
Đặt kim loại là R, hóa trị x.
R là Fe.
Câu 28:
Cho 0,1 mol Gly-Ala tác dụng với dung dịch KOH dư, đun nóng. Sau khi các phản ứng xảy ra hoàn toàn, số mol KOH đã phản ứng là
 Xem đáp án
Xem đáp án
Chọn A.
Câu 29:
Cho các thí nghiệm sau:
(1) Điện phân dung dịch CuSO4 với điện cực trơ.
(2) Cho Al vào dung dịch H2SO4 loãng, nguội.
(3) Cho FeS vào dung dịch HCl.
(4) Sục khí CO2 vào dung dịch Na2SiO3.
(5) Đun nóng hỗn hợp rắn gồm C và Fe3O4.
(6) Đun sôi nước cứng tạm thời.
Sau khi các phản ứng xảy ra hoàn toàn, số thí nghiệm tạo ra sản phẩm khí là
 Xem đáp án
Xem đáp án
Chọn D.
(1)
(2)
(3)
(4)
(5)
(6) (Mg là Mg, Ca)
Câu 30:
Dẫn từ từ khí CO2 đến dư vào dung dịch chứa x mol Ca(OH)2 và 2x mol NaOH. Sự phụ thuộc của khối lượng kết tủa thu được vào số mol CO2 phản ứng được biểu diễn theo đồ thị sau:
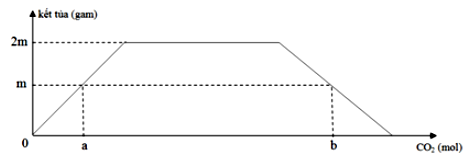
Tỉ lệ b : a là
 Xem đáp án
Xem đáp án
Chọn A.
Khi thì các sản phẩm thu được gồm
Bảo toàn
Câu 31:
Hợp chất X mạch hở có công thức phân tử C6H8O4. Từ X thực hiện sơ đồ chuyển hóa như sau (theo đúng tỉ lệ mol):
(1) X + 2NaOH → X1 + X2 + X3.
(2) X2 + CO → CH3COOH.
(3) 2X3 + O2 → 2CH3COOH.
(4) X1 + H2SO4 → X4 + Na2SO4.
Phát biểu nào sau đây không đúng?
 Xem đáp án
Xem đáp án
Chọn B.
là
là
là
X1 là
là
Phát biểu B sai.
Câu 32:
Cho các phát biểu sau:
(1) Đun nóng hỗn hợp rượu trắng, giấm ăn và H2SO4 loãng, thu được etyl axetat.
(2) Thủy phân xenlulozơ trong dung dịch NaOH đun nóng, thu được glucozơ.
(3) Axit Glutamic, Lysin là các chất lưỡng tính.
(4) Tơ visco, tơ xenlulozơ axetat, cao su lưu hóa đều là các polime bán tổng hợp.
(5) Ở nhiệt độ thường, các amin đều là các chất lỏng.
(6) Bơ nhân tạo được điều chế bằng phản ứng hiđro hóa chất béo lỏng.
Số phát biểu đúng là
 Xem đáp án
Xem đáp án
Chọn D.
(1) Sai, phản ứng este hóa không xảy ra trong điều kiện như vậy
(2) Sai, xenlulozơ không bị thủy phân trong kiềm.
(3) Đúng
(4) Đúng
(5) Sai, các amin có thể dạng khí hoặc rắn.
(6) Đúng
Câu 33:
Cho các hỗn hợp (tỉ lệ mol các chất tương ứng) và thực hiện các thí nghiệm sau:
(a) Hỗn hợp gồm Al2O3 và Na (1 : 2) cho vào nước dư.
(b) Hỗn hợp gồm Fe2(SO4)3 và Cu (1 : 1) cho vào nước dư.
(c) Hỗn hợp gồm BaO và Na2SO4 (1 : 1) cho vào nước dư.
(d) Hỗn hợp gồm Al4C3 và CaC2 (1 : 2) vào nước dư.
(e) Hỗn hợp gồm BaCl2 và NaHCO3 (1 : 1) cho vào dung dịch NaOH dư.
Số thí nghiệm mà hỗn hợp chất rắn tan hoàn toàn và tạo thành dung dịch trong suốt là
 Xem đáp án
Xem đáp án
Chọn D.
(a)
(b)
(c)
(d)
(e)Câu 34:
Đốt cháy hoàn toàn 13,728 gam một triglixerit X cần vừa đủ 27,776 lít O2 (đktc) thu được số mol CO2 và số mol H2O hơn kém nhau 0,064. Mặt khác, hiđro hóa hoàn toàn một lượng X cần 0,096 mol H2 thu được m gam chất hữu cơ Y. Xà phòng hóa hoàn toàn m gam Y bằng dung dịch NaOH thu được dung dịch chứa a gam muối. Giá trị của a là
 Xem đáp án
Xem đáp án
Chọn B.
và
Bảo toàn khối lượng:
và
Bảo toàn O:
và
Mặt khác,
cộng 2H2.
và
Bảo toàn khối lượng:
m muối
m muối = 42,72 gam.
Câu 35:
Đun nóng hỗn hợp X gồm 0,1 mol etilen; 0,1 mol vinylaxetilen và 0,3 mol hiđro với xúc tác Ni một thời gian, thu được hỗn hợp Y có tỉ khối so với hiđro bằng 10,75. Cho toàn bộ Y vào dung dịch brom dư thấy có tối đa a mol brom phản ứng. Giá trị của a là
 Xem đáp án
Xem đáp án
Chọn A.
Bảo toàn khối lượng:
phản ứng
Bảo toàn liên kết pi:
phản ứng
Câu 36:
 Xem đáp án
Xem đáp án
Chọn A.
Dung dịch sau điện phân tác dụng với Mg tạo NO
nên đã bị điện phân ở anot.
Mặt khác khối lượng Mg tăng nên có dư.
Anot: và
Catot:
Bảo toàn electron:
m giảm
và
dư = c, bảo toàn electron:
phản ứng
phản ứng
Ban đầu: (B sai)
Muối khan gồm
m muối A đúng.
X chứa C sai.
phản ứng
Câu 37:
Trộn 8,1 gam Al với 35,2 gam hỗn hợp rắn X gồm Fe, FeO, Fe3O4, Fe2O2 và Fe(NO3)2 thu được hỗn hợp Y. Hòa tan hoàn toàn Y vào dung dịch chứa 1,9 mol HCl và 0,15 mol HNO3, khuấy đều cho các phản ứng xảy ra hoàn toàn, thu được dung dịch Z (không chứa muối amoni) và 0,275 mol hỗn hợp khí T gồm NO và N2O. Cho dung dịch AgNO3 đến dư vào dung dịch Z. Sau khi các phản ứng xảy ra hoàn toàn thu được dung dịch M; 0,025 mol khí NO (sản phẩm khử duy nhất của N+5) và 280,75 gam kết tủa. Phần trăm khối lượng của Fe(NO3)2 trong Y là:
 Xem đáp án
Xem đáp án
Chọn A.
dư = 0,1
Bảo toàn electron
Dung dịch Z chứa dư (0,12),
Bảo toàn điện tích
Quy đổi hỗn hợp Y thành và
Khí T gồm NO (c) và
Bảo toàn N
phản ứng
Giải hệ
Câu 38:
X, Y là hai axit cacboxylic đều đơn chức, hơn kém nhau một nguyên tử cacbon; Z là ancol no, hai chức; T là este mạch hở được tạo bởi X, Y, Z. Đốt cháy 45,72 gam hỗn hợp E chứa X, Y, Z, T cần dùng 2,41 mol O2, thu được 27,36 gam nước. Hidro hóa hoàn toàn 45,72 gam E cần dùng 0,65 mol H2 (xúc tác Ni, to) thu được hỗn hợp F. Đun nóng toàn bộ F cần dùng 400 ml dung dịch NaOH 1M, cô cạn dung dịch sau phản ứng thu được hỗn hợp M chứa 41,9 gam muối. Phần trăm khối lượng của T có trong hỗn hợp E là
 Xem đáp án
Xem đáp án
Chọn A.
nên:
Đốt F cần mol O2
và thu được
Quy đổi F thành:
mol (Tính từ )
mol
mol
M muối
và
Đặt và là số liên kết ![]() trong X, Y
trong X, Y
và là nghiệm duy nhất
Vậy X là và Y là
Phản ứng cháy tính được:
và
T là
Câu 39:
Tiến hành thí nghiệm điều chế etyl axetat theo các bước sau đây:
Bước 1: Cho 1 ml C2H5OH, 1 ml CH3COOH và vài giọt dung dịch H2SO4 đặc vào ống nghiệm.
Bước 2: Lắc đều ống nghiệm, đun cách thủy (trong nồi nước nóng) khoảng 5 – 6 phút ở 65 – 70°C.
Bước 3: Làm lạnh, sau đó rót 2 ml dung dịch NaCl bão hòa vào ống nghiệm.
Cho các phát biểu sau:
(a) Có thể thay dung dịch axit sunfuric đặc bằng dung dịch axit sunfuric loãng.
(b) Để kiểm soát nhiệt độ trong quá trình đun nóng có thể dùng nhiệt kế.
(c) Dung dịch NaCl bão hòa được thêm vào ống nghiệm để phản ứng đạt hiệu suất cao hơn.
(d) Có thể thay dung dịch NaCl bão hòa bằng dung dịch HCl bão hòa.
(e) Để hiệu suất phản ứng cao hơn nên dùng dung dịch axit axetic 15%.
(f) Mục đích chính của việc làm lạnh là để cho hơi etyl axetat ngưng tụ.
Số phát biểu đúng là
 Xem đáp án
Xem đáp án
Chọn A.
(a) Sai, loãng không có tác dụng hút
(b) Đúng
(c) Sai, thêm dung dịch NaCl bão hòa để este tách ra
(d) Sai, HCl dễ bay hơi.
(e) Sai, để hiệu suất cao cần hạn chế tối đa sự có mặt của .
(f) Sai, với nhiệt độ thực hiện phản ứng thì sản phẩm este
đang ở trạng thái lỏng. Làm lạnh để hạn chế thất thoát.
Câu 40:
 Xem đáp án
Xem đáp án
Chọn C.
2 khí nên X là
Y là tripeptit Gly-Gy-Ala
các chất hữu cơ gồm
m chất hữu cơ
Các muối gồm:
m muối = 40,9r
