Đề thi thử THPT Quốc gia môn Hóa năm 2022 chọn lọc, có lời giải (30 đề)
Đề thi thử THPT Quốc gia môn Hóa năm 2022 chọn lọc, có lời giải (Đề 14)
-
6213 lượt thi
-
40 câu hỏi
-
50 phút
Danh sách câu hỏi
Câu 1:
 Xem đáp án
Xem đáp án
Câu 3:
Kim loại Fe phản ứng được với dung dịch nào sau đây tạo thành muối sắt(III)?
 Xem đáp án
Xem đáp án
Câu 4:
 Xem đáp án
Xem đáp án
Chọn A
Nước cứng chứa Ion Ca2+, Mg2+ , Cl-, SO42-
nên dung phương kết tủa để tách 2 ion trên ra khỏi dung dịch
M2+ + CO32- MCO3 . Chất phù hợp là Na2CO3
Câu 5:
Dãy các kim loại được xếp theo chiều giảm dần tính khử là
 Xem đáp án
Xem đáp án
Chọn C
Theo dãy điện hóa thì tính khử của K>Zn>Cu
Câu 6:
 Xem đáp án
Xem đáp án
Chọn B
Anot là nơi ion âm đến và xảy ra quá trình oxi hóa
NaCl Na+ + Cl-
Tại Anot : 2Cl- + 2e
Câu 8:
Polime nào sau đây có cấu trúc mạng không gian?
 Xem đáp án
Xem đáp án
Câu 9:
Dẫn khí axetilen vào dung dịch AgNO3 trong NH3 dư, xuất hiện kết tủa màu
 Xem đáp án
Xem đáp án
Câu 10:
Cho kim loại X vào dung dịch CuSO4, thu được hỗn hợp kết tủa và có khí thoát ra. Kim loại X là
 Xem đáp án
Xem đáp án
Chọn C
X tác dụng với có khí và hỗn hợp kết tủa
X tác dụng với và có tạo kết với
Ba + +
Câu 11:
Nhúng thanh nhôm vào dung dịch nào sau đây có xảy ra ăn mòn điện hóa học?
 Xem đáp án
Xem đáp án
Chọn A
Nhúng thanh Al vào xảy ra ăn mòn điện hóa
Câu 12:
Chất nào sau đây là amin bậc hai?
 Xem đáp án
Xem đáp án
Câu 14:
Nước sông khi chứa nhiều chất phù sa gây đục có thể được làm trong bằng cách cho thêm một lượng nhỏ chất nào sau đây?
 Xem đáp án
Xem đáp án
Câu 15:
 Xem đáp án
Xem đáp án
Chọn C
Kim loại không phản ứng với ở điều kiện thường là Be
Câu 16:
Cặp chất nào sau đây có cùng công thức đơn giản?
 Xem đáp án
Xem đáp án
Chọn A
axit axetic CH3COOH (CH2O)2
Glucozo : C6H12O6 (CH2O)6
Câu 17:
 Xem đáp án
Xem đáp án
Chọn C
là thạch cao sống
Câu 18:
Ở dạng mạch hở, nhóm chức có trong phân tử glucozơ là
 Xem đáp án
Xem đáp án
Chọn A
glucozo : -CH(OH)-CH(OH)-(CH)OH-CH(OH)-CHO
có 2 nhóm –OH và –CHO
Câu 19:
 Xem đáp án
Xem đáp án
Chọn A
Câu 21:
Cho mô hình thí nghiệm sau:
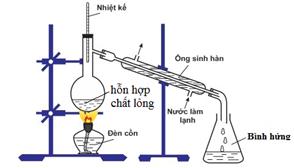
Mô hình thí nghiệm trên ứng với phương pháp tách chất nào sau đây?
 Xem đáp án
Xem đáp án
Câu 22:
Cho x mol Fe (dạng bột) vào dung dịch X chứa H2SO4 và z mol CuSO4. Sau khi các phản ứng xảy ra hoàn toàn, thu được y mol khí H2, dung dịch Y và hỗn hợp chất rắn Z chứa hai kim loại có số mol bằng nhau. Biểu thức đúng về mối liên hệ giữa x, y, z là
 Xem đáp án
Xem đáp án
Chọn A
y y ![]()
Z ![]()
nFe dư = x-y-z ( mol), hai kim loại có số mol bằng nhau
![]() x-y-z=z 2z= x-y
x-y-z=z 2z= x-y
Câu 23:
Có 4 lọ đựng 4 hỗn hợp bột: X (Fe và FeO); Y (Fe và Fe2O3); Z (FeO và Fe2O3); T (FeO) và được kí hiệu ngẫu nhiên là (a), (b), (c), (d). Lần lượt hòa tan hoàn toàn các hỗn hợp đó trong các dung dịch HCl (dư), hiện tượng quan sát được là
Hỗn hợp (a): dung dịch thu được màu lục nhạt, có khí bay ra.
Hỗn hợp (b): dung dịch thu được màu lục nhạt, không có khí bay ra.
Hỗn hợp (c): dung dịch thu được màu vàng nâu, không có khí bay ra.
Hỗn hợp (d): dung dịch thu được màu vàng nâu, có khí bay ra.
Hỗn hợp (a) là
 Xem đáp án
Xem đáp án
Câu 24:
Cho các thí nghiệm sau:
(a) Nung hỗn hợp KNO3, C và S ở nhiệt độ cao.
(b) Cho dung dịch NaOH vào dung dịch NH4Cl, đun nóng.
(c) Cho HCOOH vào dung dịch H2SO4 đặc.
(d) Cho dung dịch H2SO4 vào dung dịch Na3PO4.
(e) Cho Mg vào dung dịch CuSO4.
Số thí nghiệm có sự tạo thành chất khí là
 Xem đáp án
Xem đáp án
Chọn B
KNO3 + C + S K2S + CO2 + N2
NaOH + NH4Cl NaCl + NH3 + H2O
HCOOH CO + H2O
Na3PO4 + H2SO4 Na2SO4 + NaH2PO4
Mg + CuSO4 MgSO4 + Cu
vậy có 3 thí nghiệm tạo khí
Câu 25:
 Xem đáp án
Xem đáp án
Chọn D
= 0,4, dung dịch chỉ chứa muối axit
BTNT “C” = = 2/9 m=40(g)
Câu 26:
Nung hỗn hợp X gồm 5,4 gam Al và m gam Fe2O3 ở nhiệt độ cao trong điều kiện không có oxi. Sau một thời gian, thu được chất rắn Y. Cho Y tác dụng vừa đủ với dung dịch H2SO4 loãng, sau phản ứng thu được dung dịch Z chứa 69,4 gam muối và 5,6 lít khí H2. Giá trị của m là
 Xem đáp án
Xem đáp án
Chọn B
= 0,2 = x, = 0,25
= += 3x + 0,25
mmuối= 0,2.27 + 2x.56+ 96.(3x + 0,25)= 69,4
x=0,1 m=16
Câu 27:
Cho dãy các loại tơ sau: (1) tơ tằm; (2) tơ visco; (3) tơ nilon-6,6; (4) tơ xenlulozơ axetat; (5) tơ olon. Số tơ nhân tạo (hay bán tổng hợp) trong dãy là
 Xem đáp án
Xem đáp án
Câu 28:
Cho 16,5 gam hỗn hợp X gồm etylamin và glyxin tác dụng vừa đủ với 150 ml dung dịch H2SO4 1M, thu được dung dịch Y. Cho dung dịch NaOH dư vào Y, thu được m gam muối. Giá trị của m là
 Xem đáp án
Xem đáp án
Chọn B
=x , = y
Muối và GlyNa
m= 31g
Câu 29:
 Xem đáp án
Xem đáp án
Chọn B
Chất tác dụng với KOH đun nóng là: glyxin, Gly-Ala, phenol, etylbromua, amoniaxetat
Câu 30:
Cho dãy các chất sau: (1) C2H4O2 (không đổi màu quỳ tím); (2) fructozơ; (3) CH5O2N (muối amoni của axit cacboxylic); (4) xenlulozơ, (5) axetilen, (6) vinylaxetilen. Số chất trong dãy có phản ứng tráng gương là
 Xem đáp án
Xem đáp án
Câu 31:
Hỗn hợp X gồm hai chất hữu cơ đơn chức mạch hở là đồng phân của nhau, phân tử đều chứa C, H, O. Cho 26,4 hỗn hợp X tác dụng vừa đủ với 300 ml dung dịch NaOH 1M, đun nóng, thu được 4 gam ancol Y và m gam hỗn hợp Z gồm hai muối của hai axit cacboxylic kế tiếp nhau trong dãy đồng đẳng. Giá trị của m là
 Xem đáp án
Xem đáp án
Chọn C
= 0,3 M= 88 = 0,125
=0,175
BTKL mmuối= 31,25g
Câu 32:
 Xem đáp án
Xem đáp án
Chọn C
=3a, =a 9a+a=1 a=0,1
BTKL 286,4 + 56= + 92.0,3 + 0,1.18
= 313(g)
![]()
%m = 41,15
Câu 33:
Đun nóng 28,9 gam hỗn hợp X gồm CH4, C2H2, C3H6, CxHy (mạch hở) và H2 (trong bình kín không chứa oxi, xúc tác Ni, giả sử chỉ xảy ra phản ứng cộng H2), kết thúc phản ứng, thu được hỗn hợp Y có tỉ khối hơi so với X là . Biết Y phản ứng tối đa với a mol Br2 trong dung dịch. Mặt khác, đốt cháy hoàn toàn 1,9 mol hỗn hợp X cần vừa đủ 6,45 mol O2, thu được H2O và 4 mol CO2. Giá trị của a
 Xem đáp án
Xem đáp án
Chọn C
CH2: CO2: 0,4
H2: H2O:
BTNT “C” = 0,4 pư= 1,5+ 0,5= 6,45 = 0,9
= 57,8= 28,9 x 2 gấp đôi TN1
Thí nghiệm 1: nX =0,95 MY/MX= 19/14= nX/nY nY= 0,7
Nhh= nπ= x 0,7 = 0,25
Câu 34:
Tiến hành các thí nghiệm sau :
(a) Sục khí Cl2 vào dung dịch NaOH ở nhiệt độ cao.
(b) Cho Mg vào dung dịch HNO3 loãng, không có khí thoát ra
(c) Cho KMnO4 vào dung dịch HCl đặc, dư (đun nóng)
(d) Cho a mol P2O5 vào dung dịch chứa 2,5a mol Ba(OH)2.
(e) Cho Mg vào dung dịch Fe2(SO4)3 dư.
(f) Hấp thụ hoàn toàn 2a mol CO2 vào dung dịch chứa a mol K2CO3 và a mol KOH.
(g) Cho 3a mol NaOH vào dung dịch chứa a mol Ba(HCO3)2
Sau khi các phản ứng kết thúc, số thí nghiệm thu được hai muối là
 Xem đáp án
Xem đáp án
Chọn A
NaOH + Cl2 NaCl + NaClO3 + H2O
Cho Mg vào HNO3 loãng không có khí thoát ra
sinh ra muối NH4NO3có 2 muối
KMnO4 + HCl KCl + MnCl2 + Cl2 + H2O
nP= 2, nOH= 5 nOH/nP = 2,5 có 2 muối : PO43- và HPO42-
Cho Mg vào Fe2(SO4)3 dư thì có 3 muối MgSO4, FeSO4, Fe2(SO4)3
Bảo toàn điện tích dung dịch sau phản ứng
K+: 3a
CO32-: 3a dung dịch chỉ chứa KHCO3
H+: 3a
Ba(HCO3)2 + 2NaOH BaCO3 + Na2CO3 + 2H2O
A 2a
thu được 2 muối là BaCO3 và Na2CO3
Vậy có 5 thí nghiệm thu được 2 muối
Câu 35:
Cho các phát biểu sau:
(a) Chất béo còn được gọi là triglixerit hoặc triaxylglixerol.
(b) Xenlulozơ bị thủy phân trong dung dịch kiềm đun nóng.
(c) Cao su buna-N, buna-S đều được tổng hợp từ phản ứng đồng trùng hợp.
(d) Lực bazơ của anilin yếu hơn lực bazơ của metylamin.
(e) Tơ nilon-6,6 và tơ nitron có cùng thành phần nguyên tố.
(g) Hợp chất H2NCH2COOH3NCH3 là este của glyxin.
Số phát biểu đúng là
 Xem đáp án
Xem đáp án
Câu 36:
Bốn hợp chất X, Y, Z, T đều có công thức phân tử C4H9O4N. Các chuyển hóa dưới đây mô tả phản ứng liên quan đến bốn hợp chất trên:
(1) X + 2NaOH → X1 + X2 + X3 + H2O
(2) Y + 2NaOH → Y1 + X2 + 2H2O
(3) Z + 2NaOH → Z1 + Z2 + X3 + H2O
(4) T + 2NaOH → Z1 + T1 + X2 + H2O
Biết rằng, các hợp chất X1, X2, X3, Y1, Z1, Z2, T1 đều là hợp chất hữu cơ. Biết X2 không có chứa oxi.
Cho các nhận xét sau:
(a) Đốt cháy hoàn toàn X1 thu được số mol CO2 bằng số mol H2O.
(b) X3 có thể hòa tan Cu(OH)2 tạo phức màu xanh lam.
(c) Dung dịch của các chất X1, X2 đều làm quỳ tím hóa sang màu xanh.
(d) Hai chất Z2 và T1 đều có cùng số nguyên tử cacbon.
(e) Chất Y có hai đồng phân thõa mãn.
Số phát biểu đúng là
 Xem đáp án
Xem đáp án
Chọn D
X: CH3OOC-COONH3CH3
X1 : (COONa)2, X2: CH3NH2, X3: CH3OH
Y: HOOC-CH2-COONH3CH3
Y1: CH2(COONa)2
Z: HCOONH3--COOCH3
Z1: HCOONa, Z2: H2N-CH2-COONa
T: HCOOCH2-COONH3CH3
T1: HO-CH2-COONa
A, Đốt cháy X1 thì >
a, Sai
B, X3 là ancol đơn chức không thể hòa tan Cu(OH)2
b, Sai
C, Dung dịch của X1 và X2 đều làm quỳ tím hóa xanh
c, đúng
D, Z2và T1 có cùng số nguyên tử C
d, đúng
E, Y có 1 đồng phân thỏa mãn e, Sai
Vậy có 2 phát biểu đúng
Câu 37:
Thí nghiệm điều chế và thử tính chất của khí X được tiến hành theo các bước sau:
Bước 1: Cho 2 ml ancol etylic khan vào ống nghiệm khô đã có sẵn vài viên đá bọt (ống số 1) rồi thêm từ từ 4 ml dung dịch H2SO4 đặc và lắc đều. Nút ống số 1 bằng nút cao su có ống dẫn khí rồi lắp lên giá thí nghiệm.
Bước 2: Lắp lên giá thí nghiệm khác một ống hình trụ được đặt nằm ngang (ống số 2) rồi nhồi một nhúm bông tẩm dung dịch NaOH đặc vào phần giữa ống. Cắm ống dẫn khí của ống số 1 xuyên qua nút cao su rồi nút vào một đầu của ống số 2. Nút đầu còn lại của ống số 2 bằng nút cao su có ống dẫn khí. Nhúng ống dẫn khí của ống số 2 vào dung dịch KMnO4 đựng trong ống nghiệm (ống số 3).
Bước 3: Dùng đèn cồn đun nóng hỗn hợp trong ống số 1.
Cho các phát biểu sau:
(a) Ở bước 1, nếu thay ancol etylic bằng ancol metylic thì trong thí nghiệm vẫn thu được khí X.
(b) Bông tẩm dung dịch NaOH đặc có tác dụng loại bớt tạp chất trong khí sinh ra.
(c) Đá bọt có vai trò làm cho chất lỏng không trào lên khi đun nóng.
(d) Trong thí nghiệm trên, ở ống số 3 thu được kết tủa màu vàng.
(e) Không thu khí X bằng phương pháp dời nước vì khí X tan nhiều trong nước.
(f) Khí X cháy hoàn toàn cho ngọn lửa màu vàng, có muội than.
(g) Khí X có tác dụng kích thích hoa quả nhanh chín.
Số phát biểu đúng là
 Xem đáp án
Xem đáp án
Chọn D
Khí X là
A, ở bước 1 nếu thay bỏ bớt tạp chất b, đúng
C, Đá bọt có vai trò giữ cho chất lỏng không trào lên khi đun nóng c, đúng
D, ống 3 thu được kết tủa đen là d sai
E, thu được khí X bằng phưogn pháp dời nước vì khí X không trong nước e sai
F, khí X cháy không hết sẽ cho muội than f đúng
G, Khí X có tác dụng kích thích quả nhanh chin
Câu 38:
 Xem đáp án
Xem đáp án
Chọn D
nancol= 0,08, nH2O= 0,44, nCO2= 0,74
![]() Ancol:
Ancol:
Muối:
HCOONa: a
:(a+b)/2
: b
: 0,5a+5,5b+c= 0,74
b=0,1
: c
: 0,5a+2,5b+0,04= 0,44
c= 0,1
2 muối là HCOONa: 0,18 và : 0,1
3 este là X: : 0,06
Y: : 0,02 %mX= 22,4%
Z:: 0,1
Câu 39:
 Xem đáp án
Xem đáp án
Chọn C
Amin 2 chức Y:
= 0,5b + 0,925=1,15 b= 0,45 số nguyên tử H = 8
Câu 40:
Hòa tan hết 64,0 gam hỗn hợp rắn X gồm FeS2, FeS và Fe(NO3)3 trong dung dịch chứa HNO3 và 0,2 mol H2SO4 đun nóng. Sau khi kết thúc các phản ứng thu được dung dịch Y chỉ chứa muối sắt (III) và 11,2 lít hỗn hợp khí Z gồm NO2 và SO2. Chia dung dịch Y làm 2 phần bằng nhau.
+ Phần 1: tác dụng với lượng dư dung dịch BaCl2, thu được 13,98 gam kết tủa
+ Phần 2: tác dụng với dung dịch Ba(OH)2 dư, không thấy khí thoát ra; đồng thời lọc lấy kết tủa nung ngoài không khí đến khối lượng không đổi thu được 25,98 gam rắn khan
Phần trăm khối lượng của Fe(NO3)3 có trong hỗn hợp X là
 Xem đáp án
Xem đáp án
Chọn D
nkhí = 0,5 , nBaSO4= 0,12, kết tủa phần 2 gồm BaSO4, Fe2O3
nFe2O3= 0,15 nFe = 0,3
FeS2: a NO2
BTNT “S” = 2a+b+0,2-0,12=2a+b+0,08
= 0,42-2a-b
BTNT “N” = 1,08-2a-b-3c
