Đề thi thử THPT Quốc gia môn Hóa năm 2022 chọn lọc, có lời giải (30 đề)
Đề thi thử THPT Quốc gia môn Hóa 2022 chọn lọc, có lời giải (Đề 13)
-
6208 lượt thi
-
40 câu hỏi
-
50 phút
Danh sách câu hỏi
Câu 1:
Khi nhiệt phân hoàn toàn NaHCO3 thì sản phẩm của phản ứng nhiệt phân là
 Xem đáp án
Xem đáp án
Câu 2:
 Xem đáp án
Xem đáp án
Câu 3:
Hiện tượng xảy ra khi sục từ từ đến dư khí CO2 vào dung dịch hỗn hợp NaOH và Ba(OH)2 là:
 Xem đáp án
Xem đáp án
Câu 4:
 Xem đáp án
Xem đáp án
Câu 5:
Phản ứng hóa học xảy ra trong trường hợp nào dưới đây không thuộc loại phản ứng nhiệt nhôm?
 Xem đáp án
Xem đáp án
Câu 6:
Một số este được dùng trong hương liệu, mĩ phẩm, bột giặt... là nhờ các este
 Xem đáp án
Xem đáp án
Câu 7:
Có 2 dung dịch AlCl3 và NaOH. Cách nào sau đây không nhận ra được từng dung dịch?
 Xem đáp án
Xem đáp án
Câu 8:
Thuỷ phân este X có CTPT C4H8O2 trong dung dịch NaOH thu được hỗn hợp hai chất hữu cơ Y và Z trong đó Y có tỉ khối hơi so với H2 là 16. X có công thức là:
 Xem đáp án
Xem đáp án
Câu 9:
Cho một lá sắt vào dung dịch chứa 1 trong những muối tan sau: AlCl3, Pb(NO3)2, ZnCl2, NaNO3. Cho biết trường hợp nào xảy ra phản ứng với Fe, khối lượng (m) lá sắt tăng lên hay giảm xuống sau khi phản ứng kết thúc?
 Xem đáp án
Xem đáp án
Câu 10:
Trường hợp nào sau đây xảy ra ăn mòn điện hóa?
 Xem đáp án
Xem đáp án
Câu 11:
 Xem đáp án
Xem đáp án
Câu 12:
Để xác định trong nước tiểu của người bị bệnh tiểu đường có chứa một lượng nhỏ glucozơ, có thể dùng 2 phản ứng hoá học là:
 Xem đáp án
Xem đáp án
Câu 13:
Poli(etylen-terephtalat) được tạo thành từ phản ứng đồng trùng ngưng giữa etylen glicol với
 Xem đáp án
Xem đáp án
Câu 14:
Nguyên nhân amin có tính bazơ là:
 Xem đáp án
Xem đáp án
Câu 15:
Dãy chất nào gồm toàn các chất trong phân tử có liên kết ion là
 Xem đáp án
Xem đáp án
Câu 16:
Để phân biệt dung dịch AlCl3 và dung dịch KCl ta dùng dung dịch
 Xem đáp án
Xem đáp án
Câu 18:
Đun nóng este metyl fomat với một lượng vừa đủ dung dịch NaOH, sản phẩm thu được là:
 Xem đáp án
Xem đáp án
Câu 19:
Trong dung dịch, H2N–CH2–COOH tồn tại chủ yếu ở dạng
 Xem đáp án
Xem đáp án
Câu 20:
Ứng với CTPT C2H7O2N có bao nhiêu chất vừa phản ứng được với dung dịch NaOH, vừa phản ứng được với dung dịch HCl?
 Xem đáp án
Xem đáp án
Chọn B.
Các cấu tạo thỏa mãn:
Câu 21:
Khi sục từ từ đến dư khí CO2 vào dung dịch hỗn hợp chứa a mol Ca(OH)2 và b mol NaOH. Kết quả thí nghiệm được biểu diễn ở đồ thị sau:
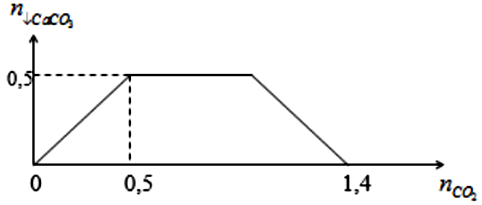
Tỉ lệ a : b là
 Xem đáp án
Xem đáp án
Chọn C.
Khi kết tủa bị hòa tan hoàn toàn thì
dung dịch chứa và
Vậy
Câu 22:
Amin bậc một X chứa vòng benzen và có công thức phân tử C8H11N. Nếu cho X tác dụng với nước brom thì thu được chất kết tủa có công thức C8H10NBr3. Số công thức cấu tạo của X là:
 Xem đáp án
Xem đáp án
Chọn D.
Sản phẩm kém 1H và hơn 3Br
đã thế 2Br vào nhân thơm và cộng 1HBr vào chức amin.
1 trong 3 vị trí o, p đã có nhóm thế.
Mặt khác, X bậc 1 nên có nhóm –NH2.
X có 5 cấu tạo thỏa mãn:
với vị tríCâu 23:
Cho hỗn hợp X gồm hai hợp chất hữu cơ no, đơn chức tác dụng vừa đủ với 100 ml dung dịch KOH 0,4M, thu được một muối và 336 ml hơi một ancol (ở đktc). Nếu đốt cháy hoàn toàn lượng hỗn hợp X trên, sau đó hấp thụ hết sản phẩm cháy vào bình đựng dung dịch Ca(OH)2 (dư) thì khối lượng dung dịch trong bình giảm 2,66 gam. Công thức của hai hợp chất hữu cơ trong X là
 Xem đáp án
Xem đáp án
Chọn C.
Hỗn hợp ban đầu gồm và
Với
Số và
Đã có số mol từng chất, kiểm tra A, C Chọn C
Câu 24:
X là dung dịch H2SO4 0,5M, Y là dung dịch NaOH 0,6M. Cần trộn X với Y theo tỉ lệ thể tích nào sau đây để được dung dịch có pH = 1?
 Xem đáp án
Xem đáp án
Chọn B.
Câu 25:
 Xem đáp án
Xem đáp án
Chọn C.
Dung dịch sau phản ứng chứa .
Câu 26:
Đốt cháy hoàn toàn 3,42 gam hỗn hợp gồm axit acrylic, vinyl axetat, metyl acrylate và axit oleic, rồi hấp thụ toàn bộ sản phẩm cháy vào dung dịch Ca(OH)2 (dư). Sau phản ứng thu được 18 gam kết tủa và dung dịch X. Khối lượng X so với khối lượng dung dịch Ca(OH)2 ban đầu đã thay đổi như thế nào?
 Xem đáp án
Xem đáp án
Chọn B.
Các chất có công thức chung là
Giảm gam.
Câu 27:
 Xem đáp án
Xem đáp án
Chọn A.
X chứa và
và
dư
Kết tủa gồm và
Câu 28:
Sục V lít (đktc) khí axetilen vào dung dịch Br2 thì Br2 phản ứng tối đa 0,3 mol. Giá trị của V là
 Xem đáp án
Xem đáp án
Chọn A.
lít
Câu 29:
Đốt cháy hoàn toàn 10,28 gam hỗn hợp X gồm hai este đơn chức, thu được 12,096 lít CO2 (đktc) và 5,4 gam H2O. Mặt khác, thủy phân hoàn toàn 10,28 gam X trong 160 ml dung dịch NaOH 1M (vừa đủ), cô cạn dung dịch sau phản ứng, thu được m gam hỗn hợp muối Y và ancol Z. Phần trăm khối lượng của muối có phân tử khối nhỏ nhất trong Y là
 Xem đáp án
Xem đáp án
Chọn A.
nên X gồm este của ancol (0,04)
và este của phenol (0,06). Đặt x, y là số C tương ứng
Với là nghiệm duy nhất.
X là và
TH1: Muối gồm và
TH2: Muối gồm và
Câu 30:
Hỗn hợp X gồm các peptit mạch hở, tạo từ các amino axit có dạng H2NCnH2nCOOH. Đốt cháy hoàn toàn m gam X cần vừa đủ 35,448 lít O2 (đktc), thu được N2 và 77,47 gam hỗn hợp CO2 và H2O. Mặt khác, thủy phân hoàn toàn m gam X trong dung dịch NaOH (vừa đủ), thu được 48,97 gam muối. Giá trị của m gần nhất với giá trị nào sau đây?
 Xem đáp án
Xem đáp án
Chọn B.
Quy đổi X thành và
m muối
Câu 31:
Clo hoá PVC được một loại tơ clorin chứa 62,39% Clo. Trung bình một phân tử Cl2 tác dụng được với
 Xem đáp án
Xem đáp án
Chọn C.
Trung bình k mắt xích tác dụng với
Sản phẩm là
Câu 32:
Xà phòng hóa hoàn toàn 0,15 mol este X (chứa C, H, O) bằng dung dịch chứa 11,2 gam KOH, thu được một ancol và dung dịch Y. Cô cạn dung dịch Y thu được 17,5 gam chất rắn khan. Mặt khác, đốt cháy hoàn toàn 0,1 mol X rồi cho sản phẩm cháy vào dung dịch Ca(OH)2 thì thu được 20g kết tủa, thêm tiếp NaOH tới dư thì thu thêm 10 gam kết tủa nữa. Tên gọi của X là:
 Xem đáp án
Xem đáp án
Chọn A.
và
Số
Chất rắn gồm
và KOH dư (0,05)
m rắn
Thủy phân X thu được ancol nên X là (etyl axetat)
Câu 33:
Cho các cặp chất với tỉ lệ số mol tương ứng như sau: (a) Fe3O4 và Cu (1:1); (b) Mg và Fe (2:1); (c) Zn và Ag (1:1); (d) Fe(NO3)3 và Cu (2:1); (e) Fe(NO3)2 và Cu (2:1); (g) FeCl3 và Cu (1:1). Số cặp chất tan hoàn toàn trong lượng dư dung dịch HCl loãng nóng là
 Xem đáp án
Xem đáp án
Chọn A.
(a)
(b)
(c) Zn tan, Ag không tan
(d)
(e)
(g) Cu không tan hết.
Câu 34:
Nung 12 gam hỗn hợp gồm Al, Al(NO3)3 trong bình kín không có oxi đến phản ứng hoàn toàn thu được một chất rắn duy nhất và V lít một khí duy nhất (đktc). V có giá trị là
 Xem đáp án
Xem đáp án
Chọn C.
Đặt a, b là số mol
bảo toàn electron
lít.
Câu 35:
 Xem đáp án
Xem đáp án
Chọn A.
n khí ban đầu mol và
n khí giảm mol
phản ứng
Câu 36:
Có các nhận xét sau:
(1) Tinh bột và xenlulozơ là hai đồng phân cấu tạo của nhau
(2) Hai đồng phân amino axit của C3H7NO2 tạo ra tối đa 3 dipeptit
(3) Khi đun nóng glucozơ (hoặc fructozơ) với dung dịch AgNO3 trong NH3 thu được Ag
(4) Thủy phân hoàn toàn tinh bột và xenlulozơ mỗi chất chỉ cho 1 loại monosaccarit duy nhất
(5) Nồng độ glucozơ trong máu người bình thường khoảng 5%
(6) Tất cả các dung dịch protein đều có phản ứng màu biure
Số nhận xét đúng là:
 Xem đáp án
Xem đáp án
Chọn A.
(1) Sai
(2) Sai, chỉ có đồng phân Ala tạo đipeptit Ala-Ala.
(3) Đúng
(4) Đúng, chỉ tạo glucozơ.
(5) Sai, khoảng 0,1%.
(6) Đúng
Câu 37:
Cho m gam ancol no, mạch hở X tác dụng hoàn toàn với CuO (dư) nung nóng, thu được hỗn hợp hơi Y (có tỉ khối hơi so với H2 là 47/3) có chất hữu cơ Z và thấy khối lượng chất rắn giảm 9,6 gam. Mặt khác đốt a mol Z, thu được b mol CO2 và c mol nước; với b = a + c. Giá trị của m là:
 Xem đáp án
Xem đáp án
Chọn D.
có là ancol 2 chức
là và Z là
Câu 38:
Điện phân 1 lít dung dịch X gồm Cu(NO3)2 0,6M và FeCl3 0,4M đến khi anot thoát ra 17,92 lít khí (đktc) thì dừng lại. Lấy catot ra khỏi bình điện phân, khuấy đều dung dịch để phản ứng xảy ra hoàn toàn thì thu được dung dịch Y. Giả thiết kim loại sinh ra đều bám lên catot, sản phẩm khử của N+5 (nếu có) là NO duy nhất. Giá trị (mX – mY) gần nhất là
 Xem đáp án
Xem đáp án
Chọn C.
và
Bảo toàn
Anot thoát ra 0,8 mol khí
Tại thời điểm bên catot hết Cu2+ thì bên anot đã có O2 từ trước đó,
khi đó , thực chất coi như sẽ bị điện phân tiếp.
Bảo toàn electron mol
Dung dịch sau điện phân chứa
Khuấy đều
Câu 39:
 Xem đáp án
Xem đáp án
Chọn D.
Đặt pư
Bảo toàn khối lượng:
Quy đổi hỗn hợp thành và
m rắn
Phần muối chứa
m muối
Giải hệ được:
dư
Bảo toàn electron:
Câu 40:
Hỗn hợp X gồm một axit cacboxylic T (hai chức, mạch hở), hai ancol đơn chức cùng dãy đồng đẳng và một este hai chức tạo bởi T với hai ancol đó. Đốt cháy hoàn toàn a gam X, thu được 16,72 gam CO2. Mặt khác, đun nóng a gam X với 200 ml dung dịch NaOH 1M, sau khi phản ứng xảy ra hoàn toàn, thêm tiếp 40 ml dung dịch HCl 1M để trung hòa lượng NaOH dư, thu được dung dịch Y. Cô cạn Y, thu được m gam muối khan và 0,1 mol hỗn hợp hai ancol có phân tử khối trung bình nhỏ hơn 46. Giá trị của m là
 Xem đáp án
Xem đáp án
Chọn D.
và
Muối gồm và
Số Muối hữu cơ 2C và 3C
TH1: và
Số
Trái với giả thiết, loại.
TH2: và
