Đề thi thử THPT Quốc gia môn Hóa năm 2022 chọn lọc, có lời giải (30 đề)
Đề thi thử THPT Quốc gia môn Hóa năm 2022 chọn lọc, có lời giải (Đề 27)
-
6192 lượt thi
-
41 câu hỏi
-
50 phút
Danh sách câu hỏi
Câu 2:
Trong y học, hợp chất nào sau đây của natri được dùng để làm thuốc trị bệnh dạ dày do dư axit
 Xem đáp án
Xem đáp án
Câu 8:
Kim loại nào sau đây tác dụng với nước thu được dung dịch kiềm?
 Xem đáp án
Xem đáp án
Câu 10:
Trong phản ứng của nhôm với dung dịch NaOH, H2O đóng vai trò gì?
 Xem đáp án
Xem đáp án
Câu 11:
 Xem đáp án
Xem đáp án
Câu 12:
Kim loại nào sau đây chỉ được điều chế bằng phương pháp điện phân nóng chảy?
 Xem đáp án
Xem đáp án
Câu 15:
Chất nào sau đây không thủy phân được trong môi trường axit, đun nóng?
 Xem đáp án
Xem đáp án
Câu 18:
Polime nào sau đây được điều chế bằng phản ứng trùng ngưng?
 Xem đáp án
Xem đáp án
Câu 19:
 Xem đáp án
Xem đáp án
Câu 21:
Chất nào sau đây không tác dụng được với dung dịch HNO3 loãng?
 Xem đáp án
Xem đáp án
Câu 22:
Hòa tan chất rắn X vào dung dịch H2SO4 loãng dư thu được dung dịch Y. Dung dịch Y hòa tan được Cu và làm mất màu dung dịch KMnO4. X là
 Xem đáp án
Xem đáp án
Chọn A
Chọn X là Fe3O4 để Y chứa Fe2+, Fe3+, H+ dư và SO .
Khi đó Y thỏa mãn tính chất:
Fe3+ + Cu —> Fe2+ + Cu2+
Fe2+ + H+ + MnO —> Fe3+ + NO + H2O
Câu 24:
Chất nào sau đây thủy phân trong dung dịch NaOH loãng, đun nóng sinh ra ancol?
 Xem đáp án
Xem đáp án
Câu 25:
 Xem đáp án
Xem đáp án
Chọn D
= 0,01.2 + 0,01.2 = 0,04
= 4,32
Câu 26:
Khối lượng của 0,08 mol Ala-Ala-Ala-Gly là
 Xem đáp án
Xem đáp án
Chọn B
m = 0,08.(89.3 + 75 – 18.3) = 23,04 gam
Câu 27:
Cho 0,2 mol FeCl2 tác dụng với dung dịch AgNO3 dư, đến phản ứng hoàn toàn thu được m gam kết tủa. Giá trị m là
 Xem đáp án
Xem đáp án
Chọn A
Ag+ + Cl- —> AgCl
Ag+ + Fe2+ —> Ag + Fe3+
—> m↓ = 79 gam
Câu 28:
 Xem đáp án
Xem đáp án
Chọn B
Na + Al + 2H2O —> NaAlO2 + 2H2
—>Na hết, Al còn dư và = 0,2
—> V = 4,48 lít
Câu 29:
Dãy các chất nào sau đây đều có phản ứng thuỷ phân trong môi trường axit?
 Xem đáp án
Xem đáp án
Câu 30:
Cho các loại tơ sau: tơ tằm, tơ visco, tơ axetat, tơ nilon-6,6. Số tơ hóa học là
 Xem đáp án
Xem đáp án
Câu 31:
X là dung dịch HCl nồng độ x mol/l. Y là dung dịch gồm Na2CO3 nồng độ y mol/l và NaHCO3 nồng độ 2y mol/l. Nhỏ từ từ đến hết 100 ml dung dịch X vào 100 ml dung dịch Y, thu được V lít khí CO2. Nhỏ từ từ đến hết 100 ml dung dịch Y vào 100 ml dung dịch X, thu được 2V lít khí CO2. Tỉ lệ x:y là
 Xem đáp án
Xem đáp án
Chọn D
và
Lượng CO2 thoát ra khác nhau
nên HCl không dư trong cả 2 thí nghiệm.
Tự chọn = 1 mol
TN1:
—> 0,1x = 0,1y + 1 (1)
TN2: Số mol phản ứng: = 0,1ky và = 0,2ky
= 2.0,1ky + 0,2ky = 0,1x —> x = 4ky
= 0,1ky + 0,2ky = 2 —> ky = 20/3
—> x = 80/3
(1) —> y = 50/3
—> x : y = 8 : 5
Câu 32:
Cho 17,82 gam hỗn hợp gồm Na, Na2O, Ba, BaO (trong đó oxi chiếm 12,57% về khối lượng) vào nước dư, thu được a mol khí H2 và dung dịch X. Cho dung dịch CuSO4 dư vào X, thu được 35,54 gam kết tủa. Giá trị của a là
 Xem đáp án
Xem đáp án
Chọn A
Quy đổi hỗn hợp thành Na (x mol), Ba (y mol) và O (0,14 mol)
—> 23x + 137y + 0,14.16 = 17,82 (1)
Dung dịch X chứa X chứa Na+ (x), Ba2+
—> = x + 2y.
X với CuSO4 dư tạo kết tủa gồm Cu(OH)2 và BaSO4.
—> m↓ = 98(x + 2y)/2 + 233y = 35,54 (2)
Giải hệ (1)(2) —> x = 0,32 và y = 0,06
Bảo toàn electron:
= x + 2y = 0,14.2 + 2a
—> a = 0,08
Câu 33:
Hình vẽ dưới đây mô tả quá trình điều chế khí metan trong phòng thí nghiệm
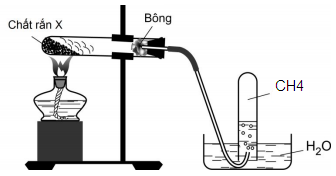
Một học sinh dựa vào thí nghiệm trên đã nêu ra các phát biểu sau:
(a) Khí metan dễ tan trong nước nên cần phải thu bằng phương pháp đẩy H2O.
(b) Các chất rắn trong X là CaO, NaOH, CH3COONa.
(c) Ống nghiệm đựng chất rắn khi lắp cần phải cho miệng hơi chúc xuống dưới.
(d) Khi kết thúc thí nghiệm phải tắt đèn cồn trước rồi mới tháo ống dẫn khí.
(e) CaO là chất bảo vệ ống thủy tinh, tránh bị nóng chảy.
Số phát biểu đúng trong các phát biểu trên là
 Xem đáp án
Xem đáp án
Chọn A
(a) Sai, CH4 không tan trong H2O
nên cần phải thu bằng phương pháp đẩy H2O.
(b) Đúng
(c) Đúng. Nếu ống nghiệm chếch lên phía trên thì
nếu hóa chất bị ẩm, khi hơi H2O thoát ra đến miệng ống gặp lạnh,
ngưng tụ lại và chảy ngược xuống dưới gây vỡ ống nghiệm.
(d) Sai, khi tắt đèn cồn trước thì nhiệt độ trong ống nghiệm
giảm làm áp suất giảm, H2O sẽ bị hút ngươc vào ống nghiệm gây vỡ ống.
Vì vậy phải tháo ống dẫn khí trước rồi mới tắt đèn cồn.
(e) Sai, CaO để hút ẩm ngăn NaOH ăn mòn thủy tinh
chứ không giúp ống tránh nóng chảy.
Câu 34:
Cho các phát biểu sau:
(a) Sục khí CO2 tới dư vào dung dịch Ba(AlO2)2 thu được kết tủa trắng.
(b) Nhỏ dung dịch NaHSO4 vào dung dịch Fe(NO3)2 có khí thoát ra.
(c) Cho dung dịch chứa a mol NaHCO3 vào dung dịch chứa a mol Ca(OH)2, sau khi kết thúc các phản ứng thu được a mol kết tủa trắng.
(d) Cho dung dịch chứa 3,5a mol HCl vào dung dịch chứa đồng thời a mol NaOH và a mol NaAlO2, sau khi kết thúc các phản ứng thu được 0,5a mol kết tủa trắng.
(e) Cho AgNO3 dư vào dung dịch FeCl3, thu được chất rắn gồm Ag và AgCl.
Số phát biểu sai là
 Xem đáp án
Xem đáp án
Chọn D
(a) Đúng
CO2 dư + Ba(AlO2)2 + H2O —> Ba(HCO3)2 + Al(OH)3
(b) Đúng:
Fe2+ + H+ + NO —> Fe3+ + NO + H2O
(c) Đúng
NaHCO3 + Ca(OH)2 —> CaCO3 + NaOH + H2O
(d) Đúng
(e) Sai
FeCl3 + AgNO3 —> AgCl + Fe(NO3)3
Câu 35:
Dẫn 3,808 lít (đktc) hỗn hợp khí X gồm butan, butađien, vinyl axetilen và hiđro đi qua Ni (đun nóng) đến phản ứng hoàn toàn, thu được 1,456 lít (đktc) hỗn hợp Y. Đốt cháy hoàn toàn Y rồi đưa toàn bộ sản phẩm vào lượng dư dung dịch Ba(OH)2, thu được 39,4 gam kết tủa, đồng thời khối lượng dung dịch giảm a gam so với ban đầu. Giá trị của a là
 Xem đáp án
Xem đáp án
Chọn A
—>X gồm C4H10, C4H6, C4H4 (tổng 0,2/4 = 0,05 mol)
và H2 (0,17 – 0,05 = 0,12 mol)
phản ứng = = 0,105 < 0,12 nên còn dư
—>Y gồm C4H10 (0,05) và H2 dư (0,015)
—> = 0,05.5 + 0,015 = 0,265
Δm = = -25,83
—> Giảm 25,83 gam
Câu 36:
Hợp chất A có công thức phân tử là C12H12O4. Thực hiện sơ đồ chuyển hóa sau:
(a) A + 3KOH → B + C + D + H2O
(b) B + 2HCl → A1 + 2KCl
(c) CH3CH=O + H2 → D
(d) C + HCl → C1 + NaCl
(e) C1 + Br2 → CH2BrCHBrCOOH
Biết A1 chứa vòng benzen. Khối lượng mol phân tử của A1 là
 Xem đáp án
Xem đáp án
Chọn A
(e) —> C1 là CH2=CH-COOH
(d) —> C là CH2=CH-COOK
(c) —> D là CH3-CH2OH
—> A là CH2=CH-COO-C6H4-COO-CH2-CH3
—> B là KO-C6H4-COOK
(b) —> A1 là HO-C6H4-COOH
—> A1 = 138
Câu 37:
Hỗn hợp X gồm axit oleic và triglixerit Y. Đốt cháy hoàn toàn 0,2 mol X cần vừa đủ 10,6 mol O2, thu được CO2 và 126 gam H2O. Mặt khác, cho 0,75 mol X tác dụng với dung dịch NaOH vừa đủ, đun nóng, thu được glixerol và m gam hỗn hợp gồm natri oleat và natri stearat. Giá trị của m là
 Xem đáp án
Xem đáp án
Chọn C
Quy đổi X thành HCOOH (a), C3H5(OH)3 (b),
CH2 (17a), H2 (c) và H2O (-3b)
= a – 3b + b = 0,2
= 0,5a + 3,5b + 1,5.17a + 0,5c = 10,6
= a + 4b + 17a + c – 3b = 7
—> a = 0,4; b = 0,1; c = -0,3
Muối gồm HCOONa (a), CH2 (17a) và H2 (c)
—> m muối = 121,8
Tỉ lệ: 0,2 mol X tạo 121,8 gam muối
—> Từ 0,75 mol X tạo m muối = 456,75 gam
Câu 38:
Trộn m gam hỗn hợp X gồm Mg, Fe, Fe3O4, Cu và CuO (trong đó nguyên tố oxi chiếm 12,82% theo khối lượng hỗn hợp X) với 7,05 gam Cu(NO3)2, thu được hỗn hợp Y. Hòa tan hoàn toàn Y trong dung dịch chứa đồng thời HCl, 0,05 mol KNO3 và 0,1 mol NaNO3. Sau khi các phản ứng xảy ra hoàn toàn thu được dung dịch Z chỉ chứa muối clorua và 3,36 lít (đktc) hỗn hợp khí T gồm N2 và NO. Tỉ khối của T so với H2 là 14,667. Cho Z phản ứng với dung dịch Ba(OH)2 dư, kết thúc phản ứng thu được 56,375 gam kết tủa. Giá trị của m gần nhất với giá trị nào sau đây?
 Xem đáp án
Xem đáp án
Chọn D
= 0,0375
Khí T gồm (0,05) và NO (0,1)
Bảo toàn N —> = 0,025
X chứa O (u mol) và kim loại (v gam)
—> = 16u = 12,82%(16u + v) (1)
m kim loại trong ↓ = v + 0,0375.64 = v + 2,4
= 2u + 1,25
Z + —> Dung dịch chứa (2u + 1,25), (0,1), (0,05)
—> = u + 0,55
—> = 2u + 1,1
—> trong ↓ = 2u + 1,1 – = 2u + 1,075
m↓ = v + 2,4 + 17(2u + 1,075) = 56,375 (2)
(1)(2) —> u = 0,25 và v = 27,2
—> = 16u + v = 31,2
Câu 39:
 Xem đáp án
Xem đáp án
Chọn B
và
—> 44u + 18v = 46,05
Bảo toàn O —> 2u + v = 1,1125.2
—> u = 0,75; v = 0,725
Amin = CH5N + kCH2
Anken = C2H4 + gCH2
Ankin = C2H2 + hCH2Quy đổi E thành CH5N (a), C2H4 (3b), C2H2 (2b), CH2 (c)
= 31a + 28.3b + 26.2b + 14c = 11,15
= a + 2.3b + 2.2b + c = 0,75
= 2,5a + 2.3b + 2b + c = 0,725
—> a = 0,05; b = 0,05; c = 0,2
= 0,05k + 0,15g + 0,1h = 0,2
—> k + 3g + 2h = 4
Với k ≥ 2; g < h —> k = 2, g = 0, h = 1 là nghiệm duy nhất.
E gồm (CH3)3N (0,05), C2H4 (0,15) và C3H4 (0,1)
—> = 50%
Câu 40:
X, Y, Z là ba este đều mạch hở, thuần chức trong đó X, Y đều đơn chức, Z hai chức. Đốt cháy hoàn toàn 19,28 gam hỗn hợp E chứa X, Y, Z cần dùng 0,94 mol O2, thu được 11,52 gam nước. Mặt khác đun nóng 19,28 gam E với dung dịch NaOH vừa đủ, thu được hỗn hợp T chứa hai ancol đều no, không thuộc cùng dãy đồng đẳng và hỗn hợp gồm hai muối có tỉ lệ mol 1 : 1. Dẫn toàn bộ T qua bình đựng Na dư, thấy khối lượng bình tăng 9,2 gam. Phần trăm khối lượng của este có khối lượng phân tử nhỏ nhất trong hỗn hợp E gần với giá trị nào nhất.
 Xem đáp án
Xem đáp án
Chọn A
= 0,64
Bảo toàn khối lượng —> = 0,86
—> / 16 = 0,48
—> = 0,24
T + Na —> = 0,24/2 = 0,12
—> = m tăng + = 9,44
Bảo toàn khối lượng —> m muối = 19,44
Hai ancol đều no, không cùng dãy đồng đẳng
—> 1 ancol đơn + 1 ancol đôi
—> Các muối đều đơn chức
n muối = = 0,24 —> M muối = 81
—> Muối gồm HCOONa (0,12) và C2H3COONa (0,12)
Bảo toàn C —> = 0,38
Bảo toàn H —> = 1,04
—> = 0,14
—>T gồm AOH (0,04) và B(OH)2 (0,1)
(Bấm hệ và để tính số mol)
= 0,38
CA ≥ 1, CB ≥ 2 —> CA = 2 và CB = 3 là nghiệm duy nhất.
HCOOC2H5: 0,02 mol —> %HCOOC2H5 = 7,68%
Câu 41:
X, Y, Z là ba este đều mạch hở, thuần chức trong đó X, Y đều đơn chức, Z hai chức. Đốt cháy hoàn toàn 19,28 gam hỗn hợp E chứa X, Y, Z cần dùng 0,94 mol O2, thu được 11,52 gam nước. Mặt khác đun nóng 19,28 gam E với dung dịch NaOH vừa đủ, thu được hỗn hợp T chứa hai ancol đều no, không thuộc cùng dãy đồng đẳng và hỗn hợp gồm hai muối có tỉ lệ mol 1 : 1. Dẫn toàn bộ T qua bình đựng Na dư, thấy khối lượng bình tăng 9,2 gam. Phần trăm khối lượng của este có khối lượng phân tử nhỏ nhất trong hỗn hợp E gần với giá trị nào nhất.
 Xem đáp án
Xem đáp án
Chọn A
= 0,64
Bảo toàn khối lượng —> = 0,86
—> / 16 = 0,48
—> = 0,24
T + Na —> = 0,24/2 = 0,12
—> = m tăng + = 9,44
Bảo toàn khối lượng —> m muối = 19,44
Hai ancol đều no, không cùng dãy đồng đẳng
—> 1 ancol đơn + 1 ancol đôi
—> Các muối đều đơn chức
n muối = = 0,24 —> M muối = 81
—> Muối gồm HCOONa (0,12) và C2H3COONa (0,12)
Bảo toàn C —> = 0,38
Bảo toàn H —> = 1,04
—> = 0,14
—> T gồm AOH (0,04) và B(OH)2 (0,1)
(Bấm hệ và để tính số mol)
= 0,38
CA ≥ 1, CB ≥ 2 —> CA = 2 và CB = 3 là nghiệm duy nhất.
T gồm C2H5OH (0,04) và C3H6(OH)2 (0,1). E gồm:
HCOOC2H5: 0,02 mol —> %HCOOC2H5 = 7,68%
C2H3COOC2H5: 0,02 mol
(HCOO)(C2H3COO)C3H6: 0,1 mol
