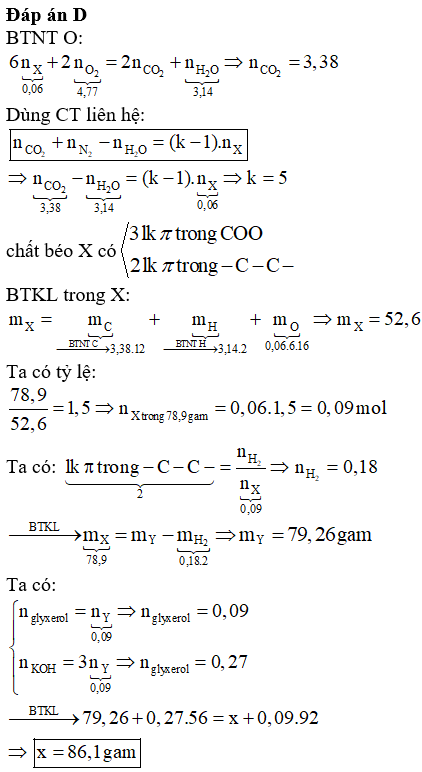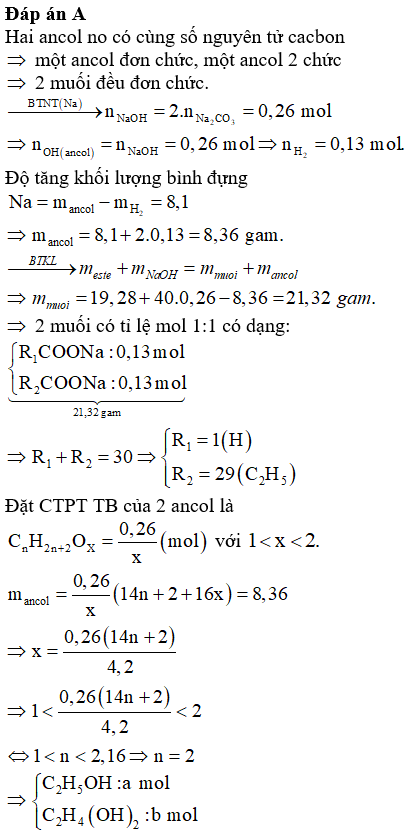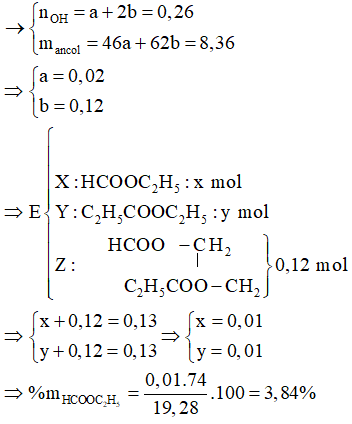30 đề thi THPT Quốc gia môn Hóa năm 2022 có lời giải (Đề số 3)
-
45506 lượt thi
-
40 câu hỏi
-
50 phút
Danh sách câu hỏi
Câu 1:
Thủy phân este X trong dung dịch axit, thu được CH3COOH và CH3OH. Công thức cấu tạo của X là
 Xem đáp án
Xem đáp án
Đáp án C.
Câu 5:
Aminoaxit X trong phân tử có hai nhóm cacboxyl và một nhóm amino. Vậy X là
 Xem đáp án
Xem đáp án
Đáp án C.
Câu 8:
Ion nào sau đây có tính oxi hóa yếu nhất?
 Xem đáp án
Xem đáp án
Đáp án A
Tính oxi hóa K+ < Mg2+ < Zn2+ < Ag+ (theo dãy điện hóa)
Câu 9:
Khi điều chế kim loại, các ion kim loại đóng vai trò là chất
 Xem đáp án
Xem đáp án
Đáp án C
Nguyên tắc điều chế kim loại là khử ion kim loại thành kim loại tự do.
Câu 10:
Trong công nghiệp, kim loại nào sau đây chỉ được điều chế bằng phương pháp điện phân nóng chảy?
 Xem đáp án
Xem đáp án
Đáp án C.
Câu 14:
Nung MgCO3 ở nhiệt độ cao, thu được chất khí X. Chất X là
 Xem đáp án
Xem đáp án
Đáp án D.
PTHH: MgCO3 MgO + CO2
Câu 15:
Trong công nghiệp, nhôm được sản xuất bằng phương pháp điện phân nóng chảy Al2O3. Nhiệt độ nỏng chảy của Al2O3 rất cao (2050oC), vì vậy phải hòa tan Al2O3 trong criolit để hạ nhiệt độ nóng chảy của hỗn hợp xuống 900oC. Công thức của criolit là
 Xem đáp án
Xem đáp án
Đáp án B.
Câu 18:
Hiện tượng “Hiệu ứng nhà kính” làm cho nhiệt độ Trái Đất nóng lên, làm biến đổi khí hậu, gây hạn hán, lũ lụt,… Tác nhân chủ yếu gây “Hiệu ứng nhà kính” là do sự tăng nồng độ trong khí quyển của chất nào sau đây?
 Xem đáp án
Xem đáp án
Đáp án D.
Câu 21:
Cho các este sau: etyl axetat, propyl axetat, metyl propionat, metyl metacrylat. Có bao nhiêu este làm mất màu dung dịch brom?
 Xem đáp án
Xem đáp án
Đáp án D.
Metyl metacrylat
Câu 22:
Thủy phân hoàn toàn hỗn hợp etyl axetat và metyl axetat trong dung dịch NaOH, thu được sản phẩm gồm
 Xem đáp án
Xem đáp án
Đáp án C.
Câu 23:
Thủy phân hoàn toàn tinh bột, thu được monosaccarit X. Hiđro hóa X, thu được chất hữu cơ Y. Hai chất X, Y lần lượt là:
 Xem đáp án
Xem đáp án
Đáp án A
Câu 24:
Thủy phân 68,4 gam saccarozơ trong môi trường axit với hiệu suất 92%, sau phản ứng thu được hỗn hợp X. Cho toàn bộ X tác dụng với lượng dư dung dịch AgNO3 trong NH3, đun nóng, phản ứng hoàn toàn thu được m gam Ag. Giá trị của m là
 Xem đáp án
Xem đáp án
Đáp án A
Câu 25:
Đốt cháy hoàn toàn m gam amin X (no, hai chức, mạch hở) thu được CO2, H2O và 1,12 lít khí N2. Cho m gam X tác dụng hết với dung dịch HCl dư, số mol HCl đã phản ứng là
 Xem đáp án
Xem đáp án
Đáp án A
Câu 26:
Phát biểu nào sau đây là đúng?
 Xem đáp án
Xem đáp án
Đáp án A
A đúng.
B sai vì bông và tơ tằm là đều thuộc loại polime thiên nhiên.
C sai vì poliacrilonitrin tạo từ monome CH2CH(CN) không chứa nguyên tố oxi.
D sai vì xenlulozơ trinitrat dùng sản xuất thuốc súng không khói.
Câu 27:
Cho 8,9 gam hỗn hợp bột Mg và Zn tác dụng với dd H2SO4 loãng (dư), thu được 0,2 mol khí H2. Khối lượng của Mg và Zn trong 8,9 gam hỗn hợp trên lần lượt là
 Xem đáp án
Xem đáp án
Đáp án B.
Đặt
Câu 28:
Cho 5,4 gam Al phản ứng hoàn toàn với khí Cl2 dư, thu được m gam muối. Giá trị của m là
 Xem đáp án
Xem đáp án
Đáp án A
Câu 29:
Cho từ từ đến dư kim loại X vào dung dịch FeCl3, sau khi phản ứng xảy ra hoàn toàn thu được hỗn hợp kim loại Fe và X dư. X là kim loại nào sau đây?
 Xem đáp án
Xem đáp án
Đáp án A.
Câu 30:
Chất nào sau đây tác dụng với dung dịch H2SO4 đặc, nóng sinh khí SO2?
 Xem đáp án
Xem đáp án
Đáp án B
PTHH: 2FeO + 4H2SO4 đặc Fe2(SO4)3 + SO2 + 4H2O
Câu 32:
Tiến hành thí nghiệm sau:
Bước 1: Rót vào hai ống nghiệm mỗi ống 1 ml etyl axetat, sau đó thêm vào ống thứ nhất 1 ml dung dịch H2SO4 20%, ống thứ hai 1 ml dung dịch NaOH 30%.
Bước 2: Lắc đều 2 ống nghiệm, đun cách thủy (trong nồi nước nóng) khoảng 5 - 6 phút ở 65 - 70oC.
Phát biểu nào sau đây đúng?
 Xem đáp án
Xem đáp án
Đáp án D
Ống nghiệm thứ nhất vẫn phân thành 2 lớp vì phản ứng thủy phân trong môi trường axit là phản ứng thuận nghịch nên este vẫn còn sau phản ứng.
Ống nghiệm thứ 2 đồng nhất vì phản ứng thủy phân trong môi trường kiềm là phản ứng một chiều nên không còn este.
Câu 33:
Cho các phát biểu sau:
(a) Các chất CH3NH2, C2H5OH, NaHCO3 đều có khả năng phản ứng với HCOOH.
(b) Thành phần chính của tinh bột là amilopectin.
(c) Các peptit đều tác dụng với Cu(OH)2 cho hợp chất có màu tím đặc trưng.
(d) Anilin (C6H5NH2) tan ít trong nước.
(e) Các chất béo no là những chất rắn, thường được gọi là dầu thực vật.
Số phát biểu đúng là
 Xem đáp án
Xem đáp án
Đáp án A.
(a) Đúng.
(b) Đúng, Amilopectin chiếm từ 70 – 80% khối lượng tinh bột trong khi amilozơ chiếm từ 20 – 30% khối lượng tinh bột.
(c) Sai, Các tripeptit trở lên (đipeptit không có phản ứng này) đều tác dụng với Cu(OH)2 cho hợp chất có màu tím đặc trưng.
(d) Đúng, Anilin (C6H5NH2) là chất lỏng, sôi ở 184oC, không màu, rất độc, tan ít trong nước nhưng tan nhiều trong benzen và etanol.
(e) Sai, Các chất béo no là những chất rắn, thường được gọi là mỡ động vật.
Câu 34:
Đốt cháy hoàn toàn 0,33 mol hỗn hợp X gồm metyl propiolat, metyl axetat và hai hidrocacbon mạch hở cần vừa đủ 1,27 mol O2, tạo ra 14,4 gam H2O. Nếu cho 0,33 mol X tác dụng với dung dịch Br2 dư thì số mol Br2 phản ứng tối đa là
 Xem đáp án
Xem đáp án
Đáp án B
Câu 35:
Hỗn hợp E gồm amin X (no, mạch hở) và hiđrocacbon Y (số mol X lớn hơn số mol Y). Đốt cháy hết 0,26 mol E cần dùng vừa đủ 2,51 mol O2, thu được N2, CO2 và 1,94 mol H2O. Mặt khác, nếu cho 0,26 mol E tác dụng với dung dịch HCl dư thì lượng HCl phản ứng tối đa là 0,28 mol. Khối lượng của Y trong 0,26 mol E là
 Xem đáp án
Xem đáp án
Đáp án C
Bảo toàn O: 2nO2 = 2nCO2 + nH2O ⇒ nCO2 = 1,54
nN = nHCl = 0,28 ó X dạng CnH2n+2+xNx (0,28/x mol)
Do nY < nX < 0,26 ⇒ 0,13 < 0,28/x < 0,26
⇒ x = 2 là nghiệm duy nhất, khi đó nX = 0,14 và nY = 0,12
Y dạng CmHy ⇒ nC = 0,14n + 0,12m = 1,54
⇒ 7n + 6m = 77 ⇒ n = 5 và m = 7 là nghiệm duy nhất. ó X là C5H14N2 (0,14)
nH = 0,14.14 + 0,12y = 1,94.2 ⇒ y = 16 ⇒Y là C7H16 (0,12) ⇒ mY = 12 gam
Câu 36:
Hấp thụ hết 4,48 lít CO2 (đktc) vào dung dịch chứa x mol KOH và y mol K2CO3 thu được 200 ml dung dịch X. Lấy 100 ml dung dịch X cho từ từ vào 300 ml dung dịch HCl 0,5M thu được 2,688 lít khí (đktc). Mặt khác, 100 ml dung dịch X tác dụng với dung dịch Ba(OH)2 dư thu được 39,4 gam kết tủa. Giá trị của x là
 Xem đáp án
Xem đáp án
Đáp án D
Câu 37:
Hỗn hợp X gồm Na, Ba, Na2O và BaO. Hòa tan hoàn toàn 131,4 gam X vào nước, thu được 6,72 lít khí H2 (đktc) và dung dịch Y, trong đó có 123,12 gam Ba(OH)2. Hấp thụ hoàn toàn 40,32 lít khí CO2 (đktc) vào Y, thu được m gam kết tủa. Giá trị của m là
 Xem đáp án
Xem đáp án
Đáp án B
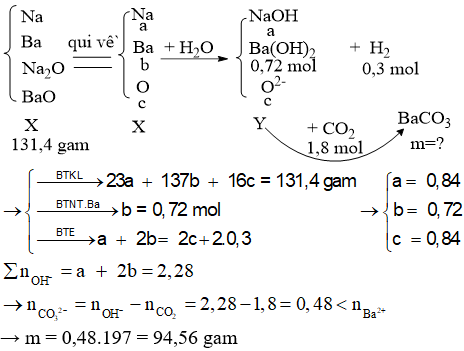
Câu 38:
Thực hiện các thí nghiệm sau:
(a) Sục CO2 đến dư vào dung dịch Ba(OH)2.
(b) Sục CO2 đến dư vào dung dịch NaAlO2 (hay Na[Al(OH)4]).
(c) Cho nước vôi vào dung dịch NaHCO3.
(d) Cho dung dịch NaOH vào lượng dư dung dịch AlCl3.
(e) Đun nóng dung dịch chứa Ca(HCO3)2.
(g) Cho mẩu Na vào dung dịch CuSO4.
Số thí nghiệm thu được kết tủa sau phản ứng là
 Xem đáp án
Xem đáp án
Đáp án B
Các phương trình phản ứng xảy ra khi tiến hành các thí nghiệm:
☒ (a) CO2 dư + Ba(OH)2 → Ba(HCO3)2.
☑ (b) CO2 + Na[Al(OH)4] → Al(OH)3↓ + NaHCO3.
☑ (c) Ca(OH)2 + 2NaHCO3 → CaCO3↓ + Na2CO3 + 2H2O.
☑ (d) 3NaOH + AlCl3 dư → NaAlO2 + 3NaCl + 2H2O.
☑ (e) Ca(HCO3)2 → CaCO3↓ + CO2↑ + H2O.
☑ (g) Na + H2O → NaOH + ½H2↑ || sau đó: 2NaOH + CuSO4 → Cu(OH)2↓ + Na2SO4.
|→ có 5 thí nghiệm thỏa mãn thu được kết tủa sau phản ứng.
Câu 40:
Cho 38,55 gam hỗn hợp X gồm Mg, Al, ZnO và Fe(NO3)2 tan hoàn toàn trong dung dịch chứa 0,725 mol H2SO4 loãng. Sau khi các phản ứng xảy ra hoàn toàn, thu được dung dịch Y chỉ chứa 96,55 gam muối sunfat trung hòa và 3,92 lít (đktc) khí Z gồm hai khí trong đó có một khí hóa nâu ngoài không khí. Biết tỉ khối của Z so với H2 là 9. Phần trăm số mol của Mg trong hỗn hợp X gần nhất với giá trị nào sau đây?
 Xem đáp án
Xem đáp án
Đáp án D