30 đề thi THPT Quốc gia môn Hóa năm 2022 có lời giải (Đề số 7)
-
45510 lượt thi
-
40 câu hỏi
-
50 phút
Danh sách câu hỏi
Câu 6:
Ở điều kiện thích hợp, kim loại Ca tác dụng với chất nào sau đây tạo thành oxit?
 Xem đáp án
Xem đáp án
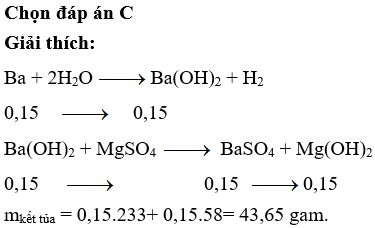
Chọn đáp án C
Câu 8:
Trong tự nhiên, canxi sunfat tồn tại dưới dạng muối ngậm nước (CaSO4.2H2O) được gọi là
 Xem đáp án
Xem đáp án
Chọn đáp án A
Câu 9:
Vào mùa lũ, để có nước sử dụng, dân cư ở một số vùng thường sử dụng chất X (Có công thức K2SO4.Al2(SO4)3.24H2O) để làm trong nước. Chất X được gọi là
 Xem đáp án
Xem đáp án
Chọn đáp án A
Câu 12:
Dẫn mẫu khí thải của một nhà máy qua dung dịch Pb(NO3)2 dư, thấy xuất hiện kết tủa màu đen. Hiện tượng đó chứng tỏ trong khí thải nhà máy có chứa khí nào sau đây?
 Xem đáp án
Xem đáp án
Chọn đáp án A
Câu 21:
X là oxit của Fe. Cho X vào dung dịch HNO3 đặc nóng, thu được dung dịch Y và không thấy có khí thoát ra. X là
 Xem đáp án
Xem đáp án
Chọn đáp án B
Giải thích:
Oxit sắt tác dụng với HNO3 không thu được khí nên là công thức oxit cao nhất Fe2O3.
Câu 22:
Hợp chất Y có công thức phân tử C4H8O2. Khi cho Y tác dụng với dung dịch NaOH sinh ra chất Z có công thức C3H5O2Na. Công thức cấu tạo của Y là
 Xem đáp án
Xem đáp án
Chọn đáp án C
Giải thích:
CH3- CH2-COO-CH3 + NaOH CH3-CH2-COONa + CH3OH
Câu 23:
Hòa tan m gam Al trong dung dịch NaOH dư, thu được 3,36 lít khí H2 (đktc) duy nhất. Giá trị của m là
 Xem đáp án
Xem đáp án
Chọn đáp án D
Giải thích:
Al + NaOH + H2O NaAlO3 + 3/2 H2
0,1 ← 0,15 mol
mAl = 0,1.27= 2,7 gam.
Câu 24:
Cho hỗn hợp Cu và Fe2O3 vào dung dịch HCl dư. Sau khi phản ứng xảy ra hoàn toàn, thu được dung dịch X và một lượng chất rắn không tan. Muối trong dung dịch X là
 Xem đáp án
Xem đáp án
Chọn đáp án B
Giải thích:
Fe2O3 + 6HCl 2FeCl3 + 3H2O
Cu + 2FeCl3 FeCl2 + CuCl2.
Vì Cu dư nên dung dịch X chứa các muối là FeCl2 và CuCl2.
Câu 26:
Thủy phân hoàn toàn hỗn hợp metyl fomat và etyl fomat trong dung dịch NaOH thu được sản phẩm gồm
 Xem đáp án
Xem đáp án
Chọn đáp án D
Câu 27:
Chất X ở dạng sợi, màu trắng, không có mùi vị và không tan trong nước. Thủy phân hoàn toàn chất X, thu được chất Y. Chất Y có nhiều trong quả nho chín nên được gọi là đường nho. Tên gọi của X và Y lần lượt là
 Xem đáp án
Xem đáp án
Chọn đáp án B
Câu 28:
Cho 18 gam dung dịch glucozơ 20% hoàn tan vừa hết m gam Cu(OH)2, tạo thành dung dịch màu xanh thẫm. Giá trị của m là
 Xem đáp án
Xem đáp án
Chọn đáp án D
Giải thích:
2C6H12O6 + Cu(OH)2 (C6H11O6)2Cu + 2H2O
0,02 0,01
Câu 29:
Dẫn V lít khí đimetylamin vào dung dịch HCl dư, cô cạn dung dịch sau phản ứng thu được 16,789 gam muối. Giá trị của V là
 Xem đáp án
Xem đáp án
Chọn đáp án A
Giải thích:
(CH3)2NH + HCl (CH3)2NH2Cl
0,206 0,206 mol
V= 0,206. 22,4= 4,6144 lít.
Câu 31:
Hấp thụ hoàn toàn 3,36 lít CO2 (đktc) vào dung dịch chứa a mol NaOH và b mol Na2CO3, thu được dung dịch X. Chia X thành hai phần bằng nhau.
+ Cho từ từ phần một vào 120 ml dung dịch HCl 1M, thu được 2,016 lít CO2 (đktc).
+ Cho phần hai phản ứng hết với dung dịch Ba(OH)2 dư, thu được 29,55 gam kết tủa.
Tỉ lệ a : b tương ứng là:
 Xem đáp án
Xem đáp án
Chọn đáp án B
Giải thích:
Gấp đôi số liệu đề bài cho ta có:
Vì dd X chứa cả HCO3- và CO32-
BT (C) ⇒
⇒ Khi tác dụng với HCl thì HCO3- và CO32- dư, HCl hết
Câu 32:
Thực hiện các thí nghiệm sau:
(a) Đun nóng nước cứng toàn phần.
(b) Cho hỗn hợp Al, Al2O3, Na (tỉ lệ mol 2:2:5) tác dụng với nước dư.
(c) Hòa tan hỗn hợp Fe3O4 và Cu (tỉ lệ mol 4:5) trong dung dịch HCl.
(d) Cho dung dịch NaHCO3 tác dụng với dung dịch BaCl2 đun nóng.
(e) Cho từng lượng nhỏ Na vào dung dịch Ba(HCO3)2.
Sau khi các phản ứng kết thúc, số thí nghiệm thu được chất rắn là
 Xem đáp án
Xem đáp án
Chọn đáp án C
Câu 33:
Xà phòng hoá hoàn toàn m gam hỗn hợp E gồm các triglixerit bằng dung dịch NaOH, thu được hỗn hợp X gồm ba muối C17HxCOONa, C15H31COONa, C17HyCOONa có tỉ lệ mol tương ứng là 3 : 4 : 5 và 7,36 gam glixerol. Đốt cháy hoàn toàn hỗn hợp E cần vừa đủ 6,14 mol O2. Giá trị của m là
 Xem đáp án
Xem đáp án
Chọn đáp án D
Giải thích:
Gọi công thức chung của cả 3 muối là
với
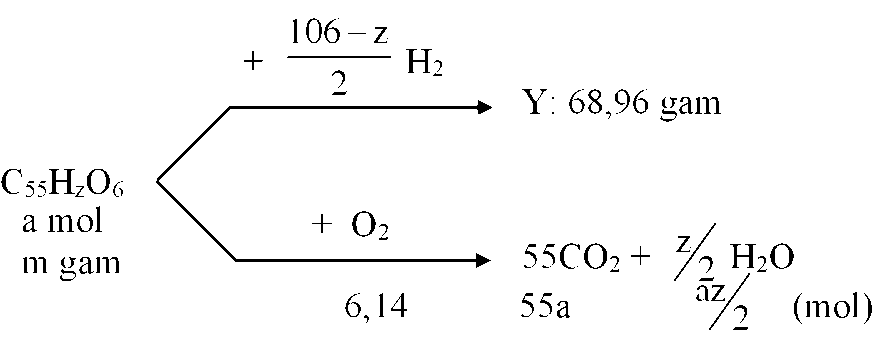
Ta có hệ
Câu 34:
Cho các phát biểu sau:
(a) Mỡ lợn hoặc dầu dừa được dùng làm nguyên liệu để điều chế xà phòng.
(b) Nước ép quả nho chín có phản ứng tráng bạc.
(c) Tơ tằm kém bền trong môi trường axit và môi trường kiềm.
(d) Cao su lưu hóa có tính đàn hồi, lâu mòn và khó tan hơn cao su thiên nhiên.
(e) Dung dịch anilin làm quỳ tím chuyển thành màu xanh.
Số phát biểu đúng là
 Xem đáp án
Xem đáp án
Chọn đáp án B
Giải thích:
Các phát biểu đúng là a, b, c, d.
Câu 35:
Hòa tan hoàn toàn m gam hỗn hợp X gồm Na, K2O, Ba và BaO (trong đó oxi chiếm 10% về khối lượng) vào nước, thu được 300 ml dung dịch Y và 0,336 lít khí H2. Trộn 300 ml dung dịch Y với 200 ml dung dịch gồm HCl 0,2M và HNO3 0,3M, thu được 500 ml dung dịch có pH = 13. Giá trị của m là
 Xem đáp án
Xem đáp án
Chọn đáp án A
Giải thích:
Câu 36:
Hỗn hợp hơi E chứa etilen, metan, axit axetic, metyl metacrylat và metylamin. Đốt cháy 0,2 mol E cần vừa đủ a mol O2, thu được 0,48 mol H2O và 1,96 gam N2. Mặt khác, 0,2 mol E tác dụng vừa đủ với 100 ml dung dịch Br2 0,7M. Giá trị a gần nhất với giá trị nào sau đây?
 Xem đáp án
Xem đáp án
Chọn đáp án B
Giải thích:
Câu 37:
Hòa tan hoàn toàn 18,94 gam hỗn hợp X gồm Al, Zn, MgO, Cu(NO3)2 cần dùng hết 430 ml dung dịch H2SO4 1M, thu được 0,19 mol hỗn hợp khí Y (đktc) gồm hai khí không màu, có một khí hóa nâu ngoài không khí, có tỉ khối hơi so với H2 bằng 5,421; dung dịch Z chỉ chứa các muối sunfat trung hòa. Cô cạn dung dịch Z thu được 54,34 gam muối khan. Phần trăm khối lượng của Al trong hỗn hợp X là
 Xem đáp án
Xem đáp án
Chọn đáp án D
Giải thích:
Sơ đồ phản ứng:
Câu 38:
Hỗn hợp X gồm ancol etylic và hai hiđrocacbon thuộc cùng dãy đồng đẳng. Hóa hơi m gam X, thu được thể tích bằng với thể tích của 0,96 gam oxi ở cùng điều kiện. Mặt khác, đốt cháy hoàn toàn m gam X cần vừa đủ 0,3 mol O2, thu được 0,195 mol CO2. Phần trăm số mol C2H5OH trong hỗn hợp là
 Xem đáp án
Xem đáp án
Chọn đáp án A
Giải thích:
Câu 39:
Đốt cháy hoàn toàn 6,72 gam hỗn hợp E gồm hai este mạch hở X, Y và este đơn chức Z (MX < MY < MZ) cần vừa đủ 0,29 mol O2, thu được 3,24 gam H2O. Mặt khác, 6,72 gam E tác dụng vừa đủ với 0,11 mol NaOH thu được 2,32 gam hai ancol no, cùng số nguyên tử cacbon, cô cạn dung dịch sau phản ứng thu được hỗn hợp T gồm 2 muối. Đốt cháy hoàn toàn T thì thu được Na2CO3, H2O và 0,155 mol CO2. Phần trăm khối lượng của Y trong E gần nhất với?
 Xem đáp án
Xem đáp án
Chọn đáp án B
Giải thích:
Câu 40:
Trong phòng thí nghiệm, etyl axetat được điều chế theo các bước:
Bước 1: Cho 1 ml ancol etylic, 1 ml axit axetic nguyên chất và 1 giọt axit sunfuric đặc vào ống nghiệm.
Bước 2: Lắc đều, đồng thời đun cách thủy 5 - 6 phút trong nồi nước nóng 65 – 70oC (hoặc đun nhẹ trên ngọn lửa đèn cồn, không được đun sôi).
Bước 3: Làm lạnh rồi rót thêm vào ống nghiệm 2 ml dung dịch NaCl bão hòa.
Cho các phát biểu sau:
(a) Axit sunfuric đặc có vai trò là chất xúc tác; hút nước để cân bằng dịch chuyển theo chiều tạo ra etyl axetat.
(b) Ở bước 2, nếu đun sôi dung dịch thì etyl axetat (sôi ở 77oC) bay hơi và thoát ra khỏi ống nghiệm.
(c) Ở bước 1, có thể thay thế ancol etylic và axit axetic nguyên chất bằng dung dịch ancol etylic 10o và axit axetic 10%.
(d) Muối ăn tăng khả năng phân tách este với hỗn hợp phản ứng thành hai lớp.
(e) Etyl axetat tạo thành có mùi thơm của dứa chín.
Số phát biểu đúng là
 Xem đáp án
Xem đáp án
Chọn đáp án C
Giải thích:
Các phát biểu đúng là a, b, d.